题目内容
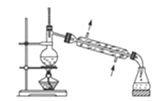
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2![]() 2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:
2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大)。请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→______→______→______→______→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式______。
(3)能证明反应中有CO生成的现象是______。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m g产品,置于蒸馏水中完全水解,并配成100 mL溶液。
②取10.00 mL溶液于锥形瓶中
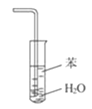
③加入V1 mL浓度为c1mol/L AgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用c2 mol/LKSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为______,步骤④中达到滴定终点的现象为______。
(5)产品中氯元素的质量分数为______。
(6)下列操作,可能引起测得产品中氯含量偏高是______。
A.步骤③中未加硝基苯
B.步骤①中配制100 mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
【答案】E H J H 将BCl3冷凝为液态分离出来 BCl3+3H2O=H3BO3+3HCl F中黑色固体变成红色且澄清石灰水变浑浊 酸式滴定管或移液 当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色 ![]() % B
% B
【解析】
(1)G制备BCl3和CO,E收集,连接干燥装置H防止水蒸气进入E,J除去氯气,H干燥CO,然后用CuO检验CO,澄清石灰水检验生成的CO2,最后收集CO,据此分析作答;
(2)BCl3接触潮湿空气时会形成白雾,生成硼酸和HCl,据此书写;
(3)CO将黑色CuO还原为红色Cu,生成CO2能使澄清石灰水变浑浊;
(4)步骤①得到酸性溶液,②取10.00 mL溶液应用酸式滴定管或移液管;根据滴定原理,KSCN与过量的硝酸银反应完后,与指示剂中铁离子结合显红色,据此可得;
(5)根据AgNO3与HCl和KSCN溶液反应,利用元素守恒可得产品中氯元素的物质的量,据此列式求解;
(6)根据AgNO3溶液发生的化学反应及误差分析方法分析判断。
(1)用Cl2、B2O3、C在加热条件下反应生成BCl3和CO,由于BCl3的熔点为-107.3℃,沸点为12.5℃,所以收集BCl3要用冰水冷却,未反应的BCl3尾气用氢氧化钠吸收,BCl3易水解,应防止氢氧化钠溶液中的水进入装置E,在E和J之间接上干燥装置H,用于吸水,生成的CO经干燥后再通过F装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有CO生成,多余的CO不能排放到空气中,要用排水法收集,据上面的分析可知,装置连接的合理顺序为G→E→H→J→H→F→D→I;反应产生的BCl3为气态,用冰水冷却降温变为液态,便于与未反应的氯气分离开来,所以其中装置E的作用是将BCl3冷凝为液态分离出来;
(2)BCl3接触潮湿空气时会形成白雾,生成硼酸和HCl,反应方程式为:BCl3+3H2O=H3BO3+3HCl;
(3)CO在加热条件下将CuO还原为Cu,CO被还原为CO2,能使澄清石灰水变浑浊,故F中黑色固体变成红色且澄清石灰水变浑浊证明反应中有CO生成;
(4)步骤①中BCl3与水反应产生硼酸和盐酸的混合物,溶液为酸性溶液,所以②取10.00 mL该溶液应用酸式滴定管或移液管;根据滴定原理,KSCN与过量的硝酸银溶液反应完后,与指示剂中铁离子结合显红色,故终点判断为:当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色;
(5)加入的AgNO3的总物质的量n(AgNO3)=c1·V1×10-3 mol,反应中过量的硝酸银的物质的量为:c2·V2×10-3 mol,则发生Ag++Cl-=AgCl↓反应的AgNO3的物质的量n(AgNO3)=c1·V1×10-3mol- c2·V2×10-3mol=(c1·V1 -c2·V2)×10-3 mol,则根据元素守恒,可知产品中氯元素为n(Cl-)=(c1·V1 -c2·V2)×10-3 mol×![]() =(c1·V1 -c2·V2)×10-2 mol,故产品中氯元素的质量分数为:
=(c1·V1 -c2·V2)×10-2 mol,故产品中氯元素的质量分数为:![]() ×100%=
×100%=![]() %;
%;
(6)A.步骤③中未加硝基苯,根据Ksp(AgCl)>Ksp(AgSCN),AgCl与KSCN反应,消耗标准液多,剩余硝酸银偏多,导致结果偏低,A错误;
B.步骤①中配制100 mL溶液时,定容时俯视刻度线,导致溶液浓度偏大,所取溶液中氯元素偏多,测定结果偏高,B正确;
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡,则标准液体积消耗读数偏高,剩余硝酸银偏多,导致结果偏低,C错误;
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴,消耗标准液体积偏多,则剩余硝酸银偏多,导致结果偏低,D错误;
故合理选项是B。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:
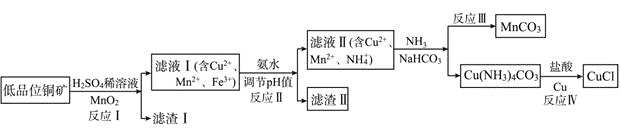
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
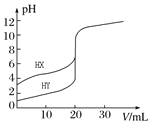
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)NaOH稍过量的原因是_______。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),理由是________。
(4)他们记录的实验数据如下:
实 验 用 品 | 溶液温度 | ||
t1 | t2 | ||
① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
50 mL 0.50mol/L盐酸 | |||
② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
50 mL 0.50mol/L盐酸 | |||
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______(填“偏大”“偏小”或“不变”),其原因是_______。
【题目】某校兴趣小组的同学围绕Fe3+和S2-的反应,产生了激烈的争辩,请你帮助他们完成相应的记录
(1)甲同学认为,类似于Fe3+和I-,Fe3+和S2-也能发生氧化还原反应。其中,甲同学提到的Fe3+和I-发生反应的离子方程式是______。
(2)乙同学认为甲同学考虑欠周,他认为Fe3+和S2-发生反应的离子方程式可能跟滴加顺序有关。如果是向氯化铁溶液中逐滴加入硫化钠溶液,离子方程式类似于(1)中的离子方程式;如果是向硫化钠溶液中逐滴加入氯化铁溶液,离子方程式则有所不同,应该为______。
(3)丙同学的看法与甲,乙两位同学都不同,既然类比,他更倾向于与![]() 和
和![]() 的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
(4)丁、戊和己三位同学急了,相约来到了实验室。其中丁同学是这样做的实验:称取______gFeCl3固体置于烧杯中,用______溶解,再加适量水配成100 mL溶液备用。取2 mL1 mol/L的FeCl3溶液于试管中,逐滴滴加0.1 mol/L的Na2S溶液。开始局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失(若不振荡,黑色沉淀慢慢消失),同时溶液呈浅黄色浑浊,且有少量的红褐色絮状沉淀产生,闻到轻微的臭鸡蛋气味;滴加到5滴Na2S溶液时,溶液开始出现少量的蓝黑色沉淀,振荡,沉淀不消失;继续滴加Na2S溶液,产生大量沉淀。戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,刚好形成补充。简述戊同学的实验操作______。
(5)已同学将戊同学在实验过程中得到的黑色沉淀A,连同实验室现有的FeS药品(分析纯)一起,做了三个小实验。
实验内容 | 实验现象 |
①A+H2O | 无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成 |
②A+HCl | 黑色沉淀溶解,并出现大量浅黄色沉淀,伴随有臭鸡蛋气味的气体生成 |
③FeS+HCl | 生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成 |
根据已同学的实验可知,黑色沉淀A可能为______![]() 填化学式
填化学式![]() ;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。