题目内容
【题目】已知常温下,氨水中![]() 的电离平衡常数:
的电离平衡常数:![]() 向1L
向1L ![]() 溶液中,不断加入固体NaOH后,
溶液中,不断加入固体NaOH后,![]() 与
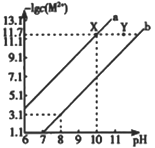
与![]() 的变化趋势如图所示
的变化趋势如图所示![]() 溶液体积和温度的变化、氨的挥发均忽略不计
溶液体积和温度的变化、氨的挥发均忽略不计![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()

A. ![]() 的电离方程式为:
的电离方程式为:![]()
B. M点时,![]()
C. ![]()
D. 当![]() mol时,溶液中有:
mol时,溶液中有:![]()
【答案】B
【解析】
![]() 在溶液中完全电离,正确的电离方程式为:
在溶液中完全电离,正确的电离方程式为:![]() ,A项错误;
,A项错误;
B.根据图象可知,M点![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,则
,则![]() ,
,![]() ,溶液的
,溶液的![]() ,B项正确;
,B项正确;
C.若![]() ,
,![]() 和NaOH反应后溶液中溶质为等物质的量的
和NaOH反应后溶液中溶质为等物质的量的![]() 和
和![]() 、NaCl,
、NaCl,![]() 的电离程度大于
的电离程度大于![]() 水解程度,导致溶液中
水解程度,导致溶液中![]() ,要使混合溶液中
,要使混合溶液中![]() ,则混合溶液中
,则混合溶液中![]() ,
,![]() ,C项错误;
,C项错误;
D.当![]() 时,
时,![]() 和NaOH反应后溶液中溶质为等物质的量的
和NaOH反应后溶液中溶质为等物质的量的![]() 和
和![]() 、NaCl,
、NaCl,![]() 的电离程度大于
的电离程度大于![]() 水解程度,导致溶液呈碱性,钠离子、氯离子不水解,所以溶液中离子浓度大小顺序为:
水解程度,导致溶液呈碱性,钠离子、氯离子不水解,所以溶液中离子浓度大小顺序为:![]() ,D项错误;
,D项错误;
答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目