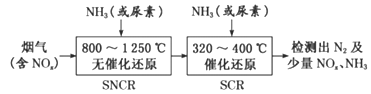
题目内容
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:

阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
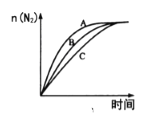
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。
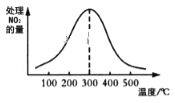
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
【答案】2NO(g)+2CO(g) =N2(g)+2CO2(g) △H= —746.5kJ·mol-1 K=![]() 0.002 体系内颜色不再发生变化 B 2NO2- +6e-+8H+=N2+4H2O E(A) 低于300℃,反应未达到平衡,温度升高,反应速度加快;高于300℃,反应已平衡,随温度升高,反应逆向进行
0.002 体系内颜色不再发生变化 B 2NO2- +6e-+8H+=N2+4H2O E(A) 低于300℃,反应未达到平衡,温度升高,反应速度加快;高于300℃,反应已平衡,随温度升高,反应逆向进行
【解析】
(1)NO(g) 与CO(g)催化转化成N2(g)和CO2(g)的反应可以由③×2-①-②得到,△H=△H3×2-△H1-△H2=-393.5-180.5-(-221)=-746.5因此热化学方程式为:2NO(g)+2CO(g) =N2(g)+2CO2(g) △H= —746.5kJ·mol-1;此反应的K值也做相应的变换K=![]() ;
;
(2)①设达到平衡时CO的浓度改变x,则:
2NO2 + 4CO![]() 4CO2 + N2
4CO2 + N2
起始(mol): 0.1 0.2 0 0
改变(mol): x 2x 2x 1/2x
平衡(mol): 0.1-x 0.2-2x 2x 1/2x
故![]() =
=![]() ,解得x=0.02,v(NO2)=
,解得x=0.02,v(NO2)= ![]() =0.002mol/(L·s);
=0.002mol/(L·s);
②若容器中观察到体系内颜色不再发生变化,可判断该反应达到平衡状态;
③A.及时分离出CO2 可使平衡向正向移动,反应速率不会增大,选项A错误;
B.适当升高温度,可增大反应速率,此反应是吸热反应,升温逆向移动,选项B正确;
C.减小容器体积使体系压强增大,平衡向气体物质的量减小的方向移动,即正向移动,选项C错误;
D.选择高效催化剂,只改变反应速率,对平衡没有影响,选项D错误;
答案选B;
(3)①活化能越小反应速率越快,所以活化能最小的是E(A);
②低于300℃,反应未达到平衡,温度升高,反应速度加快;高于300℃,反应已平衡,随温度升高,反应逆向进行,所以相同时间处理NO2的量与温度关系图中曲线先增大后减小。

 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案