题目内容
【题目】在一定温度下,下列叙述不是可逆反应:A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A的体积分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ①⑥ C. ②④ D. ③⑧
【答案】A
【解析】
①C生成的速率相当于v(正),C分解的速率相当于v(逆),且v(正)= v(逆),可以判定反应达到平衡状态,正确;
②单位时间内生成a mol A,同时生成3a mol B,反应速率同向,不能判断反应是否达到平衡状态,错误;
③A、B、C的浓度不再变化,可以判定反应达到平衡状态,正确;
④A的体积分数不再变化,浓度保持不变,可以判定反应达到平衡状态,正确;
⑤该反应为反应前后气体体积发生变化的反应,当混合气体的总压强不再变化时,可以判定反应达到平衡状态,正确;
⑥该反应中各物质均为气体,反应前后气体的总量发生变化,所以当混合气体的总物质的量不再变化,可以判断反应达到平衡状态,正确;
⑦单位时间内消耗a mol A,相当于v(正),同时生成3a mol B ,相当于v(逆),且速率之比和系数成正比,因此可以判定反应达到平衡状态,正确;
⑧平衡时各组成成分的含量不再改变,但不一定等于化学式前的系数之比,不能判断反应是否达到平衡状态,错误;
综上所述,本题选A。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________。
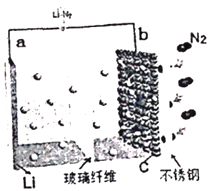
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
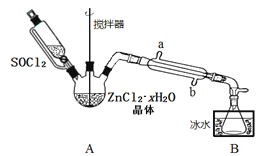
①SOCl2在该实验中的作用_________________________________;加热条件下,A装置中总的化学方程式为_________________________________。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________(保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若无明显现象 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |