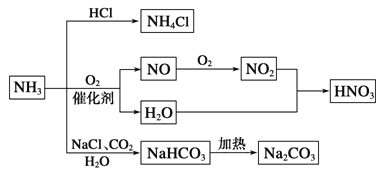
��Ŀ����
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮
ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ��

(1)Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��_____________________��Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ��__________________________��Bװ���е�������_________��
(2)ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������______________ ��
(3)ʵ�����ʱ����ȥ���оƾ���֮ǰ������ɵ�ʵ�������_________________��
(4)ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӣ��轫��Һϡ�ͣ�����������________________________________��
ʵ���Ӧ����Ķ���̽��
(5)��ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O����a��b=______________��
cCu2S+dCuSO4+e H2O����a��b=______________��
(6)Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00mL 0.30molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ6.4g��������ͭ�IJ���Ϊ_________________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I���� ��ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
���𰸡� Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O SO2+2OH��=SO32��+H2O ��ɫ��ĩ����ɫ Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ ����ͭ˿���ر�K1 �� K2 ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� 5��4 60%
CuSO4+SO2��+2H2O SO2+2OH��=SO32��+H2O ��ɫ��ĩ����ɫ Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ ����ͭ˿���ر�K1 �� K2 ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� 5��4 60%
��������
��1��Aװ�õ��Թ���ͭ��Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ��Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O�������������������������NaOH��Ӧ�����������ƺ�ˮ�����ӷ�Ӧ����ʽΪSO2+2OH-=SO32-+H2O��ˮ���лӷ��ԣ������¶ȴٽ���ӷ����������ɵ������к���ˮ������ˮ������ʹ��ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ������Bװ���е������ǣ���ɫ��ĩ����ɫ��
CuSO4+SO2��+2H2O�������������������������NaOH��Ӧ�����������ƺ�ˮ�����ӷ�Ӧ����ʽΪSO2+2OH-=SO32-+H2O��ˮ���лӷ��ԣ������¶ȴٽ���ӷ����������ɵ������к���ˮ������ˮ������ʹ��ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ������Bװ���е������ǣ���ɫ��ĩ����ɫ��
��2��֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�أ�����Ԫ�ػ��ϼ۱仯���ɵIJ�������жϣ�������������Dװ�û��ɫ�仯Ϊ��ɫ�������ɶ�������Eװ����Ʒ�����ɫ������֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�ʵ�������ǣ�Dװ��������ͭ��ɫ���仯��˵�����������ɣ�Eװ����Ʒ����Һ��ɫ˵�������˶����������壻
��3��ʵ�����ʱ������ͭ˿����ȥ���оƾ���֮ǰ������ɵ�ʵ������ǹر�K1��K2����ֹCE�е���Һ������ը�Ѳ����ܣ�
��4����֤���ɵ���Һ�к���ͭ���ӣ���Ҫ���Թ��е�Һ�嵹��ˮ���ܽ⣬�۲��Ƿ������ɫ��Һ����Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬������ɫ��Һ֤������ͭ���ӣ�
��5��aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ-2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4
cCu2S+dCuSO4+eH2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ-2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O������a�Ub=5�U4��
Cu2S+3CuSO4+4H2O������a�Ub=5�U4��
��6������2Cu2++4I-=2CuI+I2��2S2O32-+I2=S4O62-+2I-��2Cu2+��I2��2S2O32-��
���Ƶõ���Һ������ͭ�����ʵ���Ũ��Ϊxmol/L��
2Cu2+��I2��2S2O32-��
2mol2mol
0.025xmol ��0.3��0.02��mol
2molL�U2mol=0.025xmol�U��0.3��0.02��mol
x=![]() =0.24��
=0.24��
��250mL��Һ��n��Cu2+��=0.24mol/L��0.25L=0.06mol���μӷ�Ӧ��n��Cu��=![]() =0.1mol��
=0.1mol��
������ͭ�IJ���=![]() ��100%=60%��
��100%=60%��

����Ŀ������ѧ��ѡ��3�����ʽṹ�����ʡ�
�ѱ���Ϊ��������֮��ĵ����������Ʊ������ѵ�һ���������£�

�ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ͼΪ ����ԭ�Ӻ���� ���˶�״̬����ͬ�ĵ��ӡ������Ѿ�������ͼ1��ʾ��Ϊ �ѻ�����ѻ���ʽ����
��2�����ݼ۲���ӻ������ۣ��۲���Ӷ�֮��ij�����С������˳��l��l >> l��b > b��b��lΪ�¶Ե��Ӷԣ�bΪ���ϵ��Ӷԣ��������H2O�е�H��O��H���ǿɵó��Ľ�����________��
A��180�� | B���ӽ�120������С��120�� |
C���ӽ�120����������120�� | D���ӽ�109��28������С��109��28�� |
��3����֪TiCl4��ͨ�����������ɫҺ�壬�۵�Ϊ�C37�����е�Ϊ136������֪TiCl4Ϊ________���塣
��4������TiO2��һ��Ӧ�ù㷺�Ĵ����������һ��ʵ������ͼ2���������ҵķе����Ը��ڻ�����ף���Ҫԭ���� �����������в�ȡsp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ ��

��5�����ѿ���Ľṹ����ͼ��ʾ��������λ�����������ĽǶ����� �������Ӱ�Χ����λ�����壻������λ���������������ģ��� �������Ӱ�Χ�����ѿ���Ļ�ѧʽΪ �����þ����ı߳�Ϊa pm������ѿ�����ܶ�Ϊ g.cm-3��ֻҪ������ʽ�����ؼ������ֵ����