题目内容
【题目】氧化镍为绿色粉末状固体,可用作搪瓷的密着剂和着色剂,陶瓷和玻璃的颜料。也可用作电子元件材料、催化剂和蓄电池材料。工业上可通过下列两种方法制取
NiCO3![]() NiO+CO2↑ Ni(NO3)2·6H2O
NiO+CO2↑ Ni(NO3)2·6H2O ![]() NiO+2HNO3+4H2O。
NiO+2HNO3+4H2O。
回答下列问题
(1)镍元素在元素周期表中的位置为__________,其价电子轨道表达式为____________________。
(2)上述两个反应涉及的非金属元素中第一电离能最大的元素为_________。其原子核外未成对电子数是__________。
(3)上述两个反应生成的非金属氧化物沸点较高的是_______,其主要原因是_________________。
(4)NO3-离子的空间构型是___________,其中心原子的杂化方式为___________。
(5)氧化镍晶体结构与氯化钠相似,其晶胞结构如下图,结构中氧离子采用面心立方最密堆积,镍离子的堆积方式是______________。

(6)纳米材料的表面原子占总原子数的比例极大,这是它有许多特殊性质的原因,假设某氧化镍纳米粒子的形状为立方体,其边长是氧化镍晶胞(如右图)的5倍,这种纳米颗粒的表面原子与总原子数的比为__________。
【答案】 第四周期,第Ⅷ族 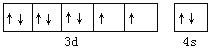 N 3 H2O 水分子间存在氢键 平面三角形 sp2 面心立方密堆积
N 3 H2O 水分子间存在氢键 平面三角形 sp2 面心立方密堆积 ![]() (或0.452或1:2.21)
(或0.452或1:2.21)
【解析】(1)镍元素核电荷数为28,基在元素周期表中的位置为第四周期第Ⅷ族,其基态原子电子排布式为[Ar]3d83s2,则价电子轨道表达式为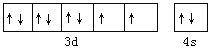 ;
;
(2)上述两个反应涉及的非金属元素有C、N、O,为周期三种元素,其第一电离能呈递增趋势,其中N元素的3p轨道为半充满结构,第一电离能相对较大,故第一电离能最大的元素为N,其原子核外未成对电子数是3;
(3)CO2和H2O均为分子晶体,其中沸点较高的是H2O,是因水分子间存在氢键的缘故;
(4)NO3-中N原子的价层电子对数为![]() =3,没有孤电子对,所以NO3-的空间构型为平面三角形,N原子杂化轨道形式为sp2;
=3,没有孤电子对,所以NO3-的空间构型为平面三角形,N原子杂化轨道形式为sp2;
(5)由晶胞结构可结构中氧离子采用面心立方最密堆积,镍离子的堆积方式也是 面心立方密堆积;
(6)氧化镍颗粒边长为晶胞边长的5倍,则每条边含有的原子数为11个,则总原子数为11的立方,表面原子总数为总原子数减去内部总原子数,内部原子总数相当于剥掉了一层晶胞,即颗粒内部每条边有9个原子,则内部原子总是为9的立方,纳米颗粒的表面原子与总原子数的比为![]() =
=![]() 。
。





