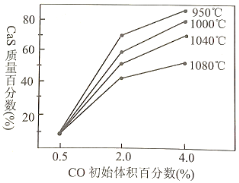
题目内容
【题目】某短周期主族元素的原子A,核外共有n个电子层(n>2),则(n-1)层所能容纳的电子数为( )
A. 8个B. 18个C. 32个D. 2个
【答案】A
【解析】
某短周期主族元素的原子A,核外共有n个电子层(n>2),因此n只能是3,则(n-1)层所能容纳的电子数为8个。答案选A。

【题目】(1)二水合草酸镓的结构如图所示,其中镓原子在周期表中的位置为__________,草酸根中碳原子的杂化方式为__________。

(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验 Fe2+的试剂,1mol CN-中含 π 键的数目为______ ,临床建议服用维生素 C 促进“亚铁”的吸收,避免生成 Fe3+,从原子结构角度来看,Fe2+易被氧化成 Fe3+的原因是___________。
(3)化合物(CH3)3N 与盐酸反应生成[(CH3) 3NH]+,该过程新生成的化学键为______(填序号)
a. 离子键 b. 配位键 c. 氢键 d. 非极性共价键
若化合物(CH3)3N 能溶于水,试解析其原因____________________。
(4)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断 Ni2+的水合离子为 __________(填“有”或“无”)色离子,依据是_____________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_______。
【题目】Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g)
CH3OH(g)
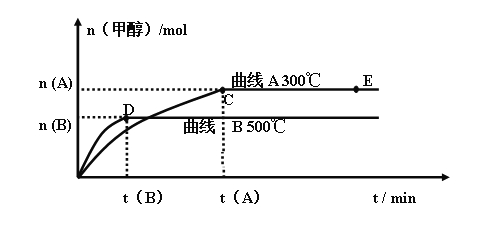
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________(填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃) | 700 | 800 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.7 | 2.6 |
(1) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、等于“”或“小于”)0.053 mol。
(2)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。