题目内容
【题目】Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g)
CH3OH(g)
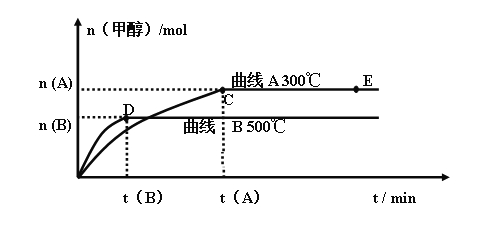
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________(填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃) | 700 | 800 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.7 | 2.6 |
(1) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、等于“”或“小于”)0.053 mol。
(2)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
【答案】减小 b c 小于 逆反应
【解析】
Ⅰ、由图象可知达到平衡后,升高温度,甲醇的物质的量减小,平衡向左移动,正反应为放热反应,因为升高温度平衡向吸热方向移动;
Ⅱ、根据表中的数据可知,温度越高,化学平衡常数越大,所以该反应为吸热反应。
Ⅰ.(1)该反应正反应为放热反应,升高温度平衡向吸热方向移动,K减小,故答案为:减小;
(2)增大压强,压缩体积,正、逆反应速率都增大,平衡向右移动,甲醇的物质的量增大,氢气的物质的量减小,但是体积缩小,氢气的浓度增大,b、c正确,故答案为:bc;
Ⅱ、(1)升高温度平衡向正反应移动,则将混合气体加热至830℃,平衡时反应物CO2的物质的量小于0.053 mol,故答案为:小于;
(2)800℃时,放入CO、H2O、CO2、H2的物质的量分别为:0.01 mol、0.01 mol、0.01 mol、0.01mol,则在1 L的密闭容器中浓度熵Q= c(CO2)c(H2)/c(CO)c(H2O)=(0.01 mol/L×0.01 mol/L)/ (0.01 mol/L×0.01 mol/L)=1>0.9,平衡向逆反应方向移动,故答案为:逆反应。