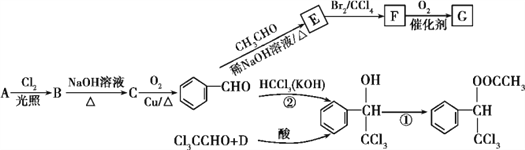
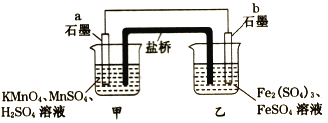
ћвƒњƒЏ»Ё
°Њћвƒњ°њ√Ї «÷Ў“™ƒ№‘і°£»Љ√Їїб ЌЈ≈SO2°ҐCOµ»”–ґЊ∆шће°£ѕы≥э”–ґЊ∆шћеµƒ—–ЊњЇЌ µЉщі”ќіЌ£÷є°£Ќк≥…ѕ¬Ѕ–ћоњ’£Ї
I.”√CaSO4ѕы≥эCO°£CaSO4ЇЌCOњ…ЈҐ…ъ»зѕ¬ЅљЄцЈі”¶£Ї
Јі”¶Ґў£ЇCaSO4£®s£©+4CO£®g£©![]() CaS£®s£©+4CO2£®g£©+175.6kJ
CaS£®s£©+4CO2£®g£©+175.6kJ
Јі”¶ҐЏ£ЇCaSO4£®s£©+4CO£®g£©![]() CaO£®s£©+SO2£®g£©+CO2£®g£©°™218.4kJ
CaO£®s£©+SO2£®g£©+CO2£®g£©°™218.4kJ
(1)–і≥цЈі”¶Ґўµƒ∆љЇв≥£ э±ніп љ£Ї_____________£ї“їґ®ћхЉюѕ¬µƒ√№±’»Ё∆ч÷–£ђЅљЈі”¶Њщіп∆љЇвЇу£ђ»ф єЈі”¶ҐўKµƒЉх–°£ђ–и“™Єƒ±дµƒЈі”¶ћхЉю «______________£ђ‘тЈі”¶ҐЏµƒK___________£®—°ћо±аЇ≈£©°ҐЈі”¶Ґўµƒv(CO2)’э__________£®—°ћо±аЇ≈£©°£
a. ‘ціу b. Љх–° c. ≤ї±д d. ќёЈ®≈–ґѕ
£®2£©≤є»Ђѕ¬ЌЉ÷–Јі”¶ҐЏµƒƒ№Ѕњ±дїѓ Њ“вЌЉ_______________£®Љі£ђ„Ґ√ч…ъ≥…ќпƒ№Ѕњµƒіу÷¬ќї÷√Љ∞Јі”¶»»–І”¶ э÷µ£©
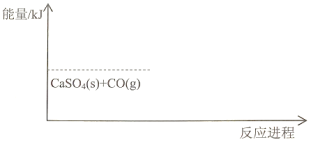
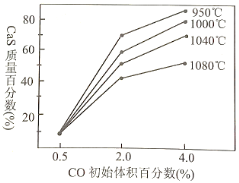
£®3£©ѕ¬ЌЉ «≤їЌђќ¬ґ»ѕ¬£ђCO≥х Љћеїэ∞ўЈ÷ э”л∆љЇв ±єћће≤ъќп÷–CaS÷ Ѕњ∞ўЈ÷ эµƒєЎѕµ«ъѕя°£–і≥цЅљ÷÷љµµЌSO2…ъ≥…Ѕњµƒіл ©___________________________________°£
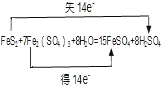
II. Fe2(SO4)3»№“Їњ…≥э»•√Ї÷–“‘ї∆ћъњу£®FeS2£©–ќ љіж‘ЏµƒЅт‘™ЋЎ£ђЈі”¶»зѕ¬£Ї8H2O + FeS2+ 7Fe2(SO4)3°ъ15FeSO4+ 8H2SO4
(4)±к≥цµз„”„™“∆µƒ эƒњЇЌЈљѕт________£їїє‘≠≤ъќп «_______°£
(5)Љм—й…ѕ цЈі”¶÷–Fe2(SO4)3 «ЈсѕыЇƒЌкµƒ µ—йЈљ∞Є£Ї___________________________°£
(6)Є√ЈљЈ®µƒ”≈µг÷Ѓ“ї «Fe2(SO4)3“„‘ў…ъ°£ѕтЈі”¶Їуµƒ»№“Ї÷–Ќ®»л___________£ђЊЌƒ№іпµљ єFe2(SO4)3‘ў…ъµƒƒњµƒ£ђЈљ±г«“ЉџЅЃ°£
°Њір∞Є°њ![]() …эЄяќ¬ґ» a a
…эЄяќ¬ґ» a a 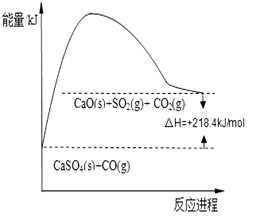 µчљЏCO≥х Љћеїэ∞ўЈ÷ эќ™
µчљЏCO≥х Љћеїэ∞ўЈ÷ эќ™![]() „у”“°ҐњЎ÷∆ќ¬ґ»‘Џ
„у”“°ҐњЎ÷∆ќ¬ґ»‘Џ![]() „󔓵»
„󔓵» 
![]() »°…ѕ≤г«е“Ї£ђµќЉ”ЉЄµќKSCN»№“Ї£ђ»фќё√чѕ‘ѕ÷ѕу£ђ‘т
»°…ѕ≤г«е“Ї£ђµќЉ”ЉЄµќKSCN»№“Ї£ђ»фќё√чѕ‘ѕ÷ѕу£ђ‘т![]() “—ѕыЇƒЌк£ђ»ф»№“Ї±дЇм‘т√їѕыЇƒЌк њ’∆ш
“—ѕыЇƒЌк£ђ»ф»№“Ї±дЇм‘т√їѕыЇƒЌк њ’∆ш
°Њљвќц°њ
(1)ЄщЊЁ∆љЇв≥£ эґ®“е–і≥цЈі”¶Ґўµƒ∆љЇв≥£ эkµƒ±ніп љ£їЈі”¶Ґў’эѕт «Ј≈»»Јі”¶£ђЈі”¶ҐЏ’эѕт «ќь»»Јі”¶£ђ…эЄяќ¬ґ»£ђЈі”¶Ґў∆љЇвƒжѕт“∆ґѓ°ҐЈі”¶ҐЏ∆љЇв’эѕт“∆ґѓ£ї
(2)Јіґ»ҐЏ’эѕт «ќь»»Јі”¶£ђЈі”¶»»°чH=+218.4kJ/mol£ї
(3)љµµЌSO2…ъ≥…Ѕњ£ђЊЌ «њЎ÷∆ћхЉю єЈі”¶ҐЏЈҐ…ъµƒњ…ƒ№–‘Љх–°їтЉ”»лєэЅњCaOљЂSO2ќь ’£ї”…ЌЉѕуњ…÷™ќ¬ґ»‘Џ950°ж„у”“ ±CaS÷ Ѕњ∞ўЈ÷ э„оіу°ҐCO≥х Љћеїэ∞ўЈ÷ эќ™4.0%„у”“ ±CaS÷ Ѕњ∞ўЈ÷ э„оіу£ђSO2…ъ≥…Ѕњ„о–°£ї
(4)Јі”¶÷–2Єц-1ЉџS‘≠„”±ї—хїѓ…ъ≥…2ЄцH2SO4Ј÷„”£ђ І»•14Єцµз„”£ђЌђ ±14Єц+3ЉџFe3+µ√µљ14Єцµз„”…ъ≥…Fe2+£ђЋщ“‘FeSO4 «їє‘≠≤ъќп£ђЊЁіЋ±к≥цµз„”„™“∆µƒ эƒњЇЌЈљѕт£ї
(5)Јі”¶÷–Fe2(SO4)3 «ЈсѕыЇƒЌк÷ї–и“™Љм—й»№“Ї÷– «ЈсЇђ”–Fe3+£ђЋщ“‘»°…ѕ≤г«е“ЇµќЉ”KSCN»№“Ї£ђЄщЊЁ—’…Ђ±дїѓ≈–ґѕ£ї
(6) FeSO4”–їє‘≠–‘£ђ єFeSO4„™їѓќ™Fe2(SO4)3Јљ±г«“ЉџЅЃµƒ ‘ЉЅ «њ’∆ш°£
£®1£©Јі”¶Ґўїѓ—І∆љЇв≥£ эKќ™c4(CO2)/c4(CO)£їЈі”¶Ґўќ™Ј≈»»Јі”¶£ђ…эЄяќ¬ґ»£ђЈі”¶Ћў¬ ‘ціу£ђ∆љЇвƒжѕт“∆ґѓ£ђїѓ—І∆љЇв≥£ эKЉх–°£їЈі”¶ҐЏќ™ќь»»Јі”¶£ђ…эЄяќ¬ґ»£ђ∆љЇв’эѕт“∆ґѓ£ђїѓ—І∆љЇв≥£ эK‘ціу£ђє ір∞Єќ™£Їc4(CO2)/c4(CO)£ї…эЄяќ¬ґ»£їa£їa£ї
£®2£©Јі”¶ҐЏќ™ќь»»Јі”¶£ђ°чH=+218.4kJ/mol£ђЈі”¶ќп„№ƒ№Ѕњ–°”Џ…ъ≥…ќп„№ƒ№Ѕњ£ђ‘тƒ№Ѕњ±дїѓЌЉ Њќ™£Ї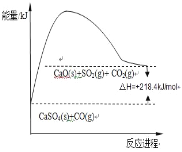 £ђє ір∞Єќ™£Ї
£ђє ір∞Єќ™£Ї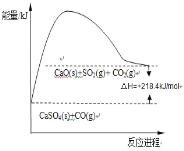 £ї
£ї
£®3£©”…ЌЉѕуњ…÷™ќ¬ґ»‘Џ950°ж„у”“ ±CaS÷ Ѕњ∞ўЈ÷ э„оіу°ҐCO≥х Љћеїэ∞ўЈ÷ эќ™4.0%„у”“ ±CaS÷ Ѕњ∞ўЈ÷ э„оіу£ђЉіЈі”¶Ґўµƒѕёґ»–°°ҐЈі”¶ҐЏµƒѕёґ»іу£ђSO2µƒ…ъ≥…Ѕњ„о–°£їїтљЂЈі”¶ҐЏ…ъ≥…µƒSO2ќь ’µф£ђ“‘љµµЌSO2…ъ≥…Ѕњ£ђє ір∞Єќ™£ЇµчљЏCO≥х Љћеїэ∞ўЈ÷ эќ™4.0%„у”“£ђњЎ÷∆Јі”¶ќ¬ґ»‘Џ950°ж„у”“£ђЉ”»лєэЅњCaOµ»£ї
£®4£©”…Јљ≥ћ љњ…÷™£ђЈі”¶÷–S‘™ЋЎїѓЇѕЉџ…эЄя£ђFeS2±ї—хїѓ£ђFe‘™ЋЎїѓЇѕЉџљµµЌ£ђFe2(SO4)3±їїє‘≠£ђFeSO4 «їє‘≠≤ъќп£ђЈі”¶÷–µ√ Іµз„” эƒњќ™14£ђє ір∞Єќ™£Ї £їFeSO4£ї
£їFeSO4£ї
£®5£©»фFe2(SO4)3±їѕыЇƒЌк£ђ»№“Ї÷–”¶Є√≤їіж‘ЏFe3+јл„”£ђЉм—йFe3+јл„”њ…“‘”√KSCNЉм—й£ђ µ—йЈљ∞Єќ™£ЇЉі»°…ѕ≤г«е“Ї£ђµќЉ”ЉЄµќKSCN»№“Ї£ђ»фќё√чѕ‘ѕ÷ѕу£ђ‘тFe2(SO4)3“—ѕыЇƒЌк£ђ»ф»№“Ї±дЇм‘т√їѕыЇƒЌк£ђє ір∞Єќ™£Ї»°…ѕ≤г«е“Ї£ђµќЉ”ЉЄµќKSCN»№“Ї£ђ»фќё√чѕ‘ѕ÷ѕу£ђ‘тFe2(SO4)3“—ѕыЇƒЌк£ђ»ф»№“Ї±дЇм‘т√їѕыЇƒЌк£ї
£®6£©FeSO4”–їє‘≠–‘£ђњ’∆ш÷–—х∆шњ…“‘љЂFeSO4—хїѓ…ъ≥…Fe2(SO4)3£ђЄ√ЈљЈ®Јљ±г«“ЉџЅЃ£ђє ір∞Єќ™£Їњ’∆ш°£

 ÷±Ќ®єу÷Ё√ы–£÷№≤⑬њЉ÷±Ќ®√ы–£ѕµЅ–ір∞Є
÷±Ќ®єу÷Ё√ы–£÷№≤⑬њЉ÷±Ќ®√ы–£ѕµЅ–ір∞Є°Њћвƒњ°њїѓ—ІЈі”¶ «їѓ—І µ—йѕ÷ѕуµƒ±Њ÷ £ђЄщЊЁ√и цїЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©‘ЏBaCl2»№“Ї÷–Ќ®»лSO2∆шће£ђќіЉы≥Ѕµн…ъ≥…£ђ»фѕ»Ќ®»лїтЉ”»лѕ¬Ѕ–µƒЅн“ї÷÷ќп÷ £ђ‘ўЌ®»лSO2≤їƒ№њіµљ≥Ѕµнµƒ”– £®ћо–тЇ≈£©£Ѓ
ҐўCl2ҐЏNaOHҐџHClҐ№FeCl3»№“ЇҐЁCO2ҐёH2SҐяNH3ҐаNaClO»№“Ї
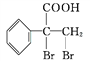
£®2£©ЌЉ÷–A°ҐB°ҐC÷ЃЉд”–“‘ѕ¬µƒ„™їѓєЎѕµ£®Є±≤ъќп“—¬‘»•£©£ї
![]()
‘тѕ¬Ѕ–ЋµЈ®’э»Јµƒ «
a£Ѓ»фA «Ј«љр фµ•÷ £ђ‘тC”лЋЃЈі”¶µƒ…ъ≥…ќпњ…ƒ№ ««њЋбїт»хЋб
b£Ѓ»фA «љр фµ•÷ £ђ‘тC”лЋЃЈі”¶µƒ…ъ≥…ќпњ…ƒ№ ««њЉо
c£Ѓ»фA «їѓЇѕќп£ђ‘тC”лЋЃЈі”¶µƒ…ъ≥…ќпњ…ƒ№ ««њЋб
£®3£©јл„”Јљ≥ћ љ «÷Ў“™µƒїѓ—І”√”п£Ѓѕ¬Ѕ– «”–єЎјл„”Јљ≥ћ љµƒ“ї–©інќуєџµг£ђ«л‘Џѕ¬Ѕ–±нЄсѕа”¶µƒ°∞јл„”Јљ≥ћ љ°±Јсґ®’в–©єџµг£Ѓ
Јі”¶ќпі”ѕ¬Ѕ–ќп÷ ÷–—°»°£ЇNa°ҐFe°ҐH2O°ҐH2SO4°ҐHCl°ҐNaOH°ҐBa£®OH£©2°ҐCuSO4
інќуєџµг | °∞Јсґ®µƒ°±јл„”Јљ≥ћ љ | |
Ґў | Ћщ”–µƒјл„”Јљ≥ћ љЊщњ…“‘±н Њ“їјаїѓ—ІЈі”¶ |
|
ҐЏ | Ћщ”–ЋбЉо÷–ЇЌЈі”¶Њщњ…±н Њќ™ H++OH©Б®TH2O |
|