题目内容
请根据题目要求回答下列问题:(1)工业接触法制硫酸的生产中用到的设备有:①沸腾炉、②________________、③吸收塔,写出在设备②中,发生的主要反应的化学方程式:________________________。
(2)已知SO2转化为SO3的反应为放热反应,下图中正确的是______________(填序号)。
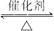
(3)在吸收塔中,为了提高SO3的吸收率,工业上选择的吸收剂是___________(填序号)。
A.H2O B.稀H2SO
(4)在101 kPa时,燃烧
(1)接触室 2SO2+O2![]() 2SO3
2SO3
(2)②
(3)C
(4)FeS2(s)+![]() O2(g)
O2(g)![]()
![]() Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1
Fe2O3(s)+2SO2(g);ΔH=-853 kJ·mol-1
解析:(2)温度升高,平衡向左移动,SO3的体积分数下降,①不对;压强增大,平衡向右移动,SO3的体积分数升高,②对.(3)SO3用98.3%的浓硫酸吸收.(4)根据题意计算得燃烧热为853 kJ·mol-1.

练习册系列答案
相关题目
 已知如表所示数据:
已知如表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g?cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | - | 338.0 | 1.84 |
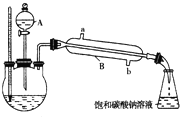
①在三颈烧瓶中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合液80mL.
②按如图所示连接好装置(装置气密性良好,加热以及夹持装置省略),用小火均匀加热装有混合液的三颈烧瓶5~10min.
③边加热,边从仪器A向三颈烧瓶中滴加乙醇.
④待锥形瓶收集到一定量产物后停止加热,用力振荡锥形瓶,然后静置待分层.
⑤分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)仪器A使用前必须进行的操作是
(2)仪器B的名称是
(3)乙醇与乙酸反应的化学方程式是
(4)实验完成后,锥形瓶里液面上有透明的不溶于水的油状液体,若分离油状液体混合物,需要用到的主要玻璃仪器是
(5)用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是
A.44g B. 29.3g C.74.8g D.88g.
 Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答: