题目内容
【题目】氮及氮的化合物在生产生活中有着重要的用途。
Ⅰ.某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水
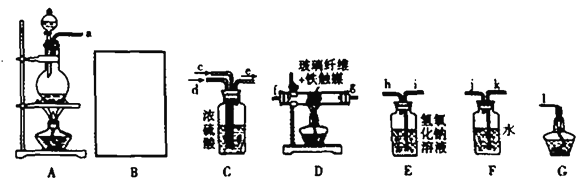
已知:加热(85℃) NH4Cl和NaNO2饱和溶液可以制取N2.
(1)用B仪器制取氢气(所用的药品是锌粒和稀盐酸)要做到“随开随用,随关随停”。可以选取下列______装置。
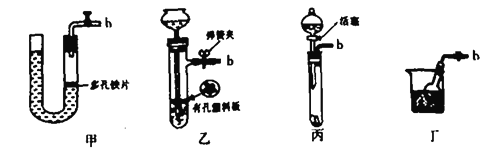
为了完成实验,装置从左到右接口的连接顺序是(装置不可重复使用):_______________
![]()
(2)D中玻璃纤维的作用是:__________。
(3)小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是:___________。
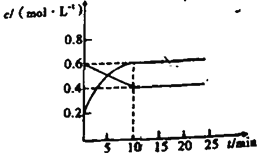
Ⅱ.在通常情况下存在2NO2(g)![]() N2O4(g)的反应。恒温下,将一定量NO2和N2O4(g)的混合气体充入容积固定的2L密闭容器中,其中各气体物质的量浓度随时间变化关系如图所示。
N2O4(g)的反应。恒温下,将一定量NO2和N2O4(g)的混合气体充入容积固定的2L密闭容器中,其中各气体物质的量浓度随时间变化关系如图所示。
(4)反应2NO2(g)![]() N2O4(g)的熵变 ΔS____0,焓变ΔH_____0(填“>”、“<“”或“=”)。
N2O4(g)的熵变 ΔS____0,焓变ΔH_____0(填“>”、“<“”或“=”)。
(5)可作为判断上述可逆反应达到平衡状态的依据的是______
A.2v(N2O4)=v(NO2)
B.容器中压强不变
C.容器中气体的密度不变
D.容器中NO2的体积分数不变
E.容器内气体的颜色不变
(6)前10min内,用v(NO2)表示的反应速率为____mol·L-1·min-1.
(7)该条件下达到平衡状态时容器中气体压强是起始时压强的____倍.
【答案】 甲乙丁 b i hc fg(或gf) kj 增大气体与催化剂铁触媒的接触面积 该反应为可逆反应,反应物的转化率低,NH3中混有较多难溶于水的气体,装置F中不会产生倒吸 < < B D E 0.04 mol·L-1·min-1 1.25
【解析】(1)用B仪器制取氢气(所用的药品是锌粒和稀盐酸)要做到“随开随用,随关随停”,甲乙丁都可以通过控制活塞的开关达到要求,丙装置无法使液体和固体分离开,使反应停止;A是氮气的发生装置,B是制取氢气的装置,C是氮气和氢气的混合并干燥的装置,D是氮气和氢气的反应装置,E中氢氧化钠可以除去氢气中的氯化氢气体,F是吸收生成的氨气的装置,G为点燃尾气中的氢气的装置。利用A中氯化铵和亚硝酸钠饱和溶液加热85°C可以制备N2,B中利用Zn与稀盐酸反应制备氢气,通过装置E除去氢气混有的HCl气体,然后和氮气通过C中浓硫酸干燥并混合后通入D中合成氨,再利用F装置中水吸收生成的氨气,氢气的尾气利用点燃的方法除去,则装置从左到右接口顺序是bihcefg(或gf)kjl,故答案为:甲乙丁;b i hc; fg(或gf) kj;
(2)D中是氮气和氢气合成氨,玻璃纤维的作用是增大气体与催化剂铁触媒的接触面积,
故答案为:增大气体与催化剂铁触媒的接触面积;
(3)小组中甲同学认为F装置不太合理,实验中会产生倒吸.乙同学认真分析后认为该装置无需改进,因为该反应为可逆反应反应物的转化率低,氨气中混有较多难溶于水的气体,装置F中不会产生倒吸,故答案为:该反应为可逆反应反应物的转化率低,氨气中混有较多难溶于水的气体,装置F中不会产生倒吸;
(4)反应2NO2(g)![]() N2O4(g)的熵变 ΔS<0,反应能够自发进行,根据△G=△H-T△S<0,焓变ΔH<0,故答案为:<;<;
N2O4(g)的熵变 ΔS<0,反应能够自发进行,根据△G=△H-T△S<0,焓变ΔH<0,故答案为:<;<;
(5)A.根据方程式,2v(N2O4)=v(NO2)始终相等,不能判断达到平衡状态,错误;B.容器中压强不变,说明气体的物质的量不变,能够说明达到平衡状态,正确;C.容器中气体的质量和条件不变,密度始终不变,不能判断达到平衡状态,错误;D.容器中NO2的体积分数不变,说明物质的量不变,说明浓度不变,能够说明达到平衡状态,正确;E.容器内气体的颜色不变,说明NO2的浓度不变,能够说明达到平衡状态,正确;故选BDE;
(6)根据图像变化可知二氧化氮增加,四氧化二氮减小,二氧化氮变化的物质的量浓度=0.6mol/L-0.2mol/L=0.4mol/L,反应速率v=![]() =
=![]() =0.04mol/(Lmin),故答案为:0.04 mol·L-1·min-1;
=0.04mol/(Lmin),故答案为:0.04 mol·L-1·min-1;
(7) 2NO2(g)![]() N2O4(g),
N2O4(g),
起始量(mol/L) 0.6 0.2
变化量(mol/L) 0.2 0.4
平衡量(mol/L) 0.4 0.6
同温同体积条件下,气体的压强之比等于物质的量之比,达到平衡状态时容器中气体压强与起始时压强之比=![]() =
=![]() =1.25,故答案为:1.25。
=1.25,故答案为:1.25。

【题目】在2L恒容密闭容器中加入0.100molNO和2.030mol固体活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
温度 | C(s)/mol | NO/mol | N2/mol | CO2/mol |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
A. 该反应的正反应为吸热反应
B. 反应体系在335℃时的平衡常数为0.25
C. 335℃与200℃时相比,活化分子个数、活化分子百分数、活化能及焓变均大
D. 200℃时,平衡后向恒容容器中再充入0.10molNO,再次平衡时,NO的百分含量将增大