题目内容
17.下列说法不正确的是( )| A. | 能电离出H+的化合物叫作酸 | |
| B. | 能电离出OH-的化合物不一定是碱 | |
| C. | 电离时生成金属离子和酸根离子的化合物叫作盐 | |
| D. | 酸、碱、盐溶液具有导电性,但溶液呈电中性 |
分析 A、电离出的阳离子全部是H+的化合物叫做酸;
B、电离出的阴离子全部是OH-的化合物叫做碱;
C、能电离出金属离子(或是铵根离子)和酸根离子的化合物都是盐;
D、根据溶液中存在自由移动的离子以及溶液的电中性原理来回答.
解答 解:A、电离出的阳离子全部是H+的化合物叫做酸,能电离出H+的化合物不一定是酸,如硫酸氢钠,故A错误;
B、电离出的阴离子全部是OH-的化合物叫做碱,能电离出OH-的化合物不一定是碱,如碱式盐,故B正确;
C、能电离出金属离子(或是铵根离子)和酸根离子的化合物都是盐,故C正确;
D、溶液中存在自由移动的离子,能导电,溶液都是电中性的,故D正确.
故选A.
点评 本题考查学生常见物质的概念和分类知识,注意知识的掌握和灵活应用,难度不大.

练习册系列答案
相关题目
7.下列有关化学键的叙述,正确的是( )
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | 水溶液能导电的化合物一定是离子化合物 | |
| C. | 化合物MgO、SiO2、SO3中化学键的类型相同 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
8.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③沸点:H2Se>H2S>H2O④结合H+能力:OH->CH3COO->I-.
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③沸点:H2Se>H2S>H2O④结合H+能力:OH->CH3COO->I-.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
5.下列反应的离子方程式中正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 碳酸钙溶于稀醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
2.氨水中存在平衡:NH3•H2O?NH4++OH-,当其他条件不变时,改变下列条件,平衡向左移动的是( )
| A. | 通入HCl | B. | 加少量NH4Cl固体 | C. | 加少量NaCl固体 | D. | 通入氨气 |
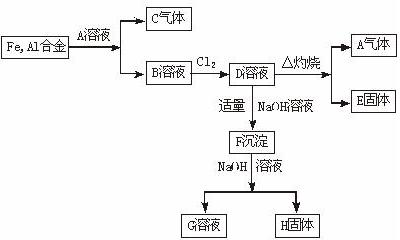 从铁、铝合金出发的反应如图所示:
从铁、铝合金出发的反应如图所示: