题目内容
8.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③沸点:H2Se>H2S>H2O④结合H+能力:OH->CH3COO->I-.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
分析 元素的非金属性越强,对应的氢化物越稳定,对应的最高价氧化物的水合物的酸性越强,对应的阴离子结合质子的能力越弱,同周期元素原子序数越大,原子半径越小,一般来说,不同晶体的熔点:原子晶体>金属晶体>分子晶体,以此解答.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,故①错误;
②Na、Mg位于相同周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Mg,O位于第二周期,原子半径在三者之间最小,故②正确;
③从两个角度考虑,水中存在氢键,沸点最高,H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2O>H2Se>H2S,故③错误;
④已知酸性H2O<H2CO3<CH3COOH,酸性越强,对应的阴离子结合质子的能力越弱,故④正确.
故选D.
点评 本题考查元素周期表和元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
18.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a( a=6 )”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a( a=6 )”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5

16.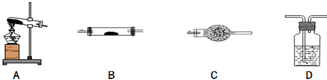 草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
(1)请你用图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4•2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去).在答题卡上填写表格(可以不用填满,也可以补充).
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是未对尾气进行处理,可造成环境污染.
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是FeC2O4•2H2O分解产生的CO将部分FeO还原为粉末状的单质铁,铁粉被空气中的氧气氧化而燃烧.
 草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O(1)请你用图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4•2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去).在答题卡上填写表格(可以不用填满,也可以补充).
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 草酸亚铁晶体 | 加热草酸亚铁晶体得到气体产物 |
| D | NaOH溶液 | |
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是FeC2O4•2H2O分解产生的CO将部分FeO还原为粉末状的单质铁,铁粉被空气中的氧气氧化而燃烧.
20.下表为元素周期表的一部分.X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | X氢化物的沸点一定比Y氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性一定比W的强 | |
| C. | XZ2、XW4与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 |
17.下列说法不正确的是( )
| A. | 能电离出H+的化合物叫作酸 | |
| B. | 能电离出OH-的化合物不一定是碱 | |
| C. | 电离时生成金属离子和酸根离子的化合物叫作盐 | |
| D. | 酸、碱、盐溶液具有导电性,但溶液呈电中性 |
16.容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下反应:
A(s)+2B(g)?C(g)+D(g),经反应5min后,测得C的浓度为0.3mol•L-1.则下列说法中正确的是( )
A(s)+2B(g)?C(g)+D(g),经反应5min后,测得C的浓度为0.3mol•L-1.则下列说法中正确的是( )
| A. | 5 min内D的平均反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min内A的平均反应速率为0.06 mol•L-1•min-1 | |
| C. | 经5 min后,向容器内再加入C,正反应速率变小 | |
| D. | 平衡状态时,生成1 mol D时同时生成1 mol A |
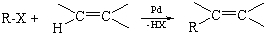
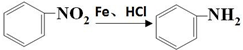

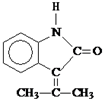 .
.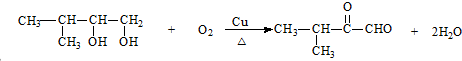 ;F→G:
;F→G: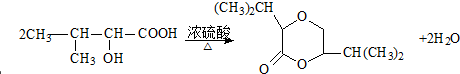 .
.