题目内容
5.钚的同位素中寿命最长的是${\;}_{94}^{244}$Pu.${\;}_{94}^{244}$Pu中电子数为94,中子数与质子数之差是56.分析 根据在原子中,原子序数=质子数=核电荷数=核外电子数,质量数=质子数+中子数,进行解答.
解答 解:${\;}_{94}^{244}$Pu中电子数与质子数相同为94,中子数=244-94=150,则中子数与质子数之差是150-94=56;
故答案为:94;56.
点评 本题考查了原子结构,题目难度不大,注意把握原子序数=质子数=核电荷数=核外电子数,质量数=质子数+中子数.

练习册系列答案
相关题目
17.下列说法不正确的是( )
| A. | 能电离出H+的化合物叫作酸 | |
| B. | 能电离出OH-的化合物不一定是碱 | |
| C. | 电离时生成金属离子和酸根离子的化合物叫作盐 | |
| D. | 酸、碱、盐溶液具有导电性,但溶液呈电中性 |
16.容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下反应:
A(s)+2B(g)?C(g)+D(g),经反应5min后,测得C的浓度为0.3mol•L-1.则下列说法中正确的是( )
A(s)+2B(g)?C(g)+D(g),经反应5min后,测得C的浓度为0.3mol•L-1.则下列说法中正确的是( )
| A. | 5 min内D的平均反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min内A的平均反应速率为0.06 mol•L-1•min-1 | |
| C. | 经5 min后,向容器内再加入C,正反应速率变小 | |
| D. | 平衡状态时,生成1 mol D时同时生成1 mol A |
13.下列化学实验事实及其解释或结论都正确的是( )
| A. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH | |
| B. | 向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 | |
| C. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 | |
| D. | 取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
20.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
| A. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生 | |
| B. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失 | |
| C. | 向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生 | |
| D. | 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生 |
10. 将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O-→NaBr+NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子为$\frac{5}{3}$mol.
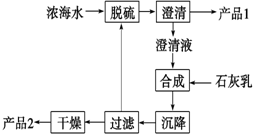
(3)海水提镁的一段工艺流程如图,浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为Ca2++SO42-=CaSO4↓,产品2的化学式为Mg(OH)2,1L浓海水最多可得到产品2的质量为69.6g.
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
 将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O-→NaBr+NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图,浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
17.下列的图示与对应的叙述相符的是( )
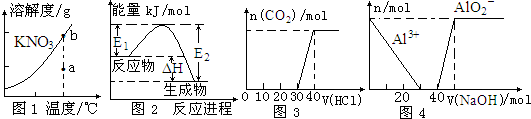

| A. | 图1表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 | |
| B. | 图2表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 | |
| C. | 图3表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 | |
| D. | 图4表示向100 mL 0.1 mol/L的AlCl3和0.1 mol/L的NH4Cl混合溶液中滴加1 mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
15.下列物质中属于纯净物的是( )
| A. | 高锰酸钾 | B. | 生理盐水 | C. | 空气 | D. | 大理石 |