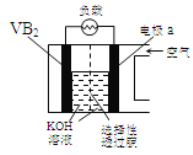
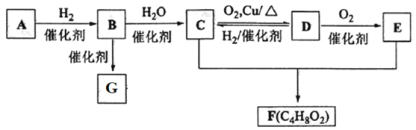
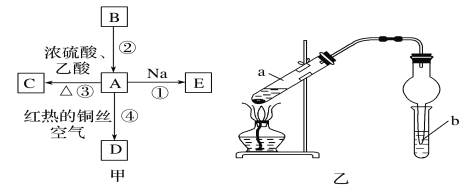
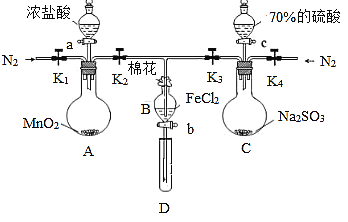
题目内容
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。
(1)求x=__。
(2)求这段时间A的平均反应速率为___。
(3)平衡时B的浓度为___。
(4)A的转化率为___。
(5)下列叙述能说明上述反应达到平衡状态的是___。
A.单位时间内每消耗2molA,同时生成1molC
B.单位时间内每生成1molB,同时生成1molC
C.D的体积分数不再变化
D.恒容容器内混合气体的压强不再变化
E.B、C的浓度之比为1∶1
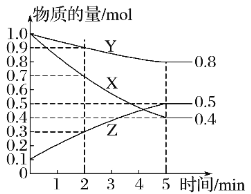
(6)某温度下在密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图,该反应的化学方程式是___。
【答案】2 0.2mol·L-1·s-1 1mol·L-1 50% BC 3X+Y![]() 2Z
2Z
【解析】
根据题干信息可建立“三段式”:
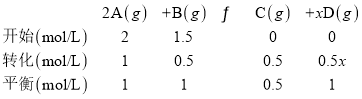
据此进行分析计算;
(1)根据“三段式”,0.5x=1,则x=2;
(2)这段时间A的平均反应速率为![]() 0.2mol·L-1·s-1 ;
0.2mol·L-1·s-1 ;
(3)根据“三段式”,平衡时B的浓度为1mol·L-1;
(4)根据“三段式”,A的转化率为![]() 50%;
50%;
(5)A.单位时间内每消耗2molA,同时生成1molC,不能判断正逆反应速率是否相等,故不选A;
B.单位时间内每生成1molB,同时生成1molC,可知正逆反应速率相等,反应一定达到平衡状态,故选B;
C.反应达到平衡时,各物质百分含量不变,若D的体积分数不再变化,反应一定平衡,故选C;
D.2A(g)+B(g)![]() C(g)+2D(g),反应前后气体物质的量不变,恒容容器内混合气体的压强是恒量,压强不再变化,不一定平衡,故不选D;
C(g)+2D(g),反应前后气体物质的量不变,恒容容器内混合气体的压强是恒量,压强不再变化,不一定平衡,故不选D;
E.B、C的浓度之比为1∶1,不一定不再变化,反应不一定平衡,故不选E;
选BC;
(6)X、Y物质的量减少,X、Y是反应物,Z物质的量增多,Z是生成物,X、Y、Z的变化量分别为0.6mol、0.2mol、0.4mol,变化量比等于系数比,该反应的化学方程式是3X+Y![]() 2Z。
2Z。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
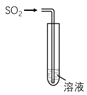
小学生10分钟应用题系列答案【题目】如右图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是
溶液 | 现象 | 结论 |
| |
A | 品红溶液 | 红色溶液褪色 | SO2有漂白性 | |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
D | 滴有酚酞的NaOH溶液 | 红色溶液褪色 | SO2的水溶液呈酸性 |
A. A B. B C. C D. D