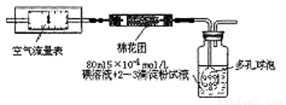
题目内容
(1)实验室配制480 mL 0.1mol·L-1 NaOH溶液,回答下列问题
① 应用托盘天平称取氢氧化钠固体_______g。
② 配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________、__________。
③ 怎样检查容量瓶是否漏水(具体操作过程)

④ 若实验遇下列情况,则所配溶液的物质的量浓度是 A、偏高 B、偏低
C、不变(用符号回答)
i 定容时俯视刻度线___________; ii 放在滤纸上称量NaOH固体_______。
iii 搅拌或转移时,有液体溅出_______ iv 未冷至室温就转移定容_______
v 转移前,容量瓶内有蒸馏水_______ vi 定容时水多用胶头滴管吸出_______
⑤请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去 (标签如图)。
(2)、配制0.25mol·L-1的NaOH溶液100mL,某学生操作如下:
I 用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
II 把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约1-2cm处,用滴管加水至刻度线。
III 写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误:
(1)__________________________;(2)_________________________
(3)__________________________;(4)_________________________
(5)__________________________;(6)_________________________
__________________________
(1)2.0 g
(2)500mL容量瓶、胶头滴管
(3)①A B B A C B
(4)NaOH溶液、0.1mol·L-1
在容量瓶内装入半瓶水,塞紧瓶塞,用右手食指顶住瓶塞,另一只手五指托住容量瓶底,将其倒立(瓶口朝下),观察容量瓶是否漏水。若不漏水,将瓶正立且将瓶塞旋转180°后,再次倒立,检查是否漏水,若两次操作,容量瓶瓶塞周围皆无水漏出,即表明容量瓶不漏水。经检查不漏水的容量瓶才能使用。
(2)NaOH应放在干燥的烧杯中称量(2)用过的游码未拨回原处(3)托盘天平只能称出0.1~0.2g,称不出1.00g(4)烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶(5)溶解NaOH应冷却后再转移至容量瓶中(6)容量瓶中的溶液未摇匀(7)配好的溶液应及时转移到有胶塞的试剂瓶内

锶(Sr)是人体必需的微量元素,其单质和化合物的化学性质与钙、钡的相似。实验室用含碳酸锶的废渣(含SrCO3 38.40%,SrO12.62%,CaCO3 38.27%,BaCO3 2.54%,其它不溶于硝酸的杂质8.17%)制备硝酸锶粗品的部分实验过程如下:

(1)市售浓硝酸的质量分数为65%,密度为1.4g/cm3,要配制30%稀硝酸500mL,还需要查阅的数据是 ,若配制过程中不使用天平,则必须要计算的数据是 ,必须要使用的仪器是 。
已知两种盐的溶解度(g/100 g水)如下表
|
温度/℃物质 |
0 |
20 |
30 |
45 |
60 |
80 |
100 |
|
Sr(NO3)2 |
28.2 |
40.7 |
47 |
47.2 |
48.3 |
49.2 |
50.7 |
|
Ca(NO3)2·4H2O |
102 |
129 |
152 |
230 |
300 |
358 |
408 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:过滤、 、 、洗涤,干燥。
已知,硝酸钙能溶于有机溶剂A中。式量:Sr(NO3)2–212、Ba(NO3)2–261、Ca(NO3)2–164
(3)制得的硝酸锶粗品中含少量Ca(NO3)2、Ba(NO3)2等杂质。测定硝酸锶纯度的实验如下:称取5.39g硝酸锶样品,加入足量的有机溶剂A,经过滤、洗涤、干燥后,剩余固体5.26g,将此固体配成250 mL的溶液,取出25.00 mL,调节pH为7,加入指示剂,用浓度为0.107mol/L的碳酸钠溶液滴定至终点,消耗碳酸钠溶液22.98mL。
滴定过程的反应:Sr2++CO32-→ SrCO3↓ Ba2++CO32-→ BaCO3↓
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②该硝酸锶粗品中,硝酸锶的质量分数为 (小数点后保留两位)。若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会 (填“偏高”、“偏低”或“不变”)。
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: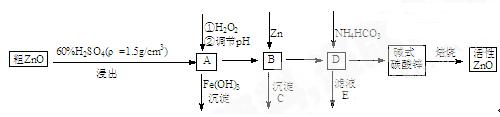
已知此溶液中Fe2+、 Fe3+、 Cu2+ 、 Zn2+形成氢氧化物的pH如下表
| 离子 | 开始沉沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7[来源:Z*xx*k.Com] |
| Zn2+ | 6.8 | 9 |
(2)在A中加H2O2的目的之一是使溶液pH升高,使Fe3+沉淀完全。另外还有一个目的是 ;在A中 (填”能”或”不能”)使Fe2+直接沉淀除去;
(3)要使A溶液顺利成为B溶液, 溶液的pH应控制在 ; B中加入Zn,既能降低氢离子浓度又能 ;
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式 .