题目内容
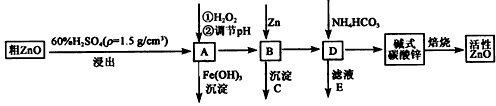
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: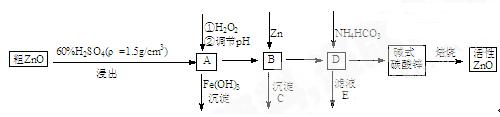
已知此溶液中Fe2+、 Fe3+、 Cu2+ 、 Zn2+形成氢氧化物的pH如下表
| 离子 | 开始沉沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7[来源:Z*xx*k.Com] |
| Zn2+ | 6.8 | 9 |
(2)在A中加H2O2的目的之一是使溶液pH升高,使Fe3+沉淀完全。另外还有一个目的是 ;在A中 (填”能”或”不能”)使Fe2+直接沉淀除去;
(3)要使A溶液顺利成为B溶液, 溶液的pH应控制在 ; B中加入Zn,既能降低氢离子浓度又能 ;
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式 .

解析

ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.7 |
|
Zn2+ |
6.8 |
9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:烧杯、量筒、 、 、 。
(2)写出在A中加H2O2的离子方程式: 。
(3)向A中可以加入 (写化学式)调节溶液pH范围在 之间;沉淀C为 。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为 。
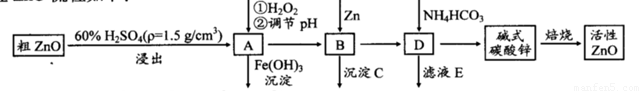
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:
已知此溶液中Fe2+ 、 Fe3+、 Cu2+ 、 Zn2+形成氢氧化物的pH如下表
|
离子 |
开始沉沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.7[来源:Z*xx*k.Com] |
|
Zn2+ |
6.8 |
9 |
(1)实验室中用98%H2SO4来配制稀硫酸所需使用的玻璃仪器有:胶头滴管、_______、_______、_______。
(2)在A中加H2O2的目的之一是使溶液pH升高,使Fe3+沉淀完全。另外还有一个目的是 ;在A中 (填”能”或”不能”)使Fe2+直接沉淀除去;
(3)要使A溶液顺利成为B溶液, 溶液的pH应控制在 ; B中加入Zn,既能降低氢离子浓度又能 ;
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式 .
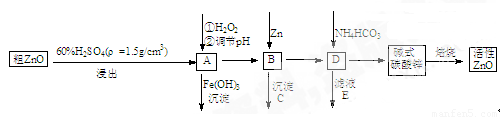
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:

已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:胶头滴管、 、 、 。
(2)写出在A中加H2O2的离子方程式: 。
(3)向A中可以加入 (写化学式)调节溶液pH范围在 之间;沉淀C为 。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为 。
(5)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________。