题目内容
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下三种测定方法。

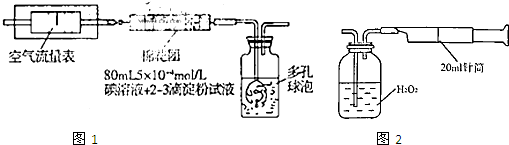
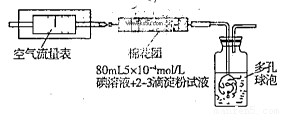
I.氧化还原法:甲同学根据化学反应原理SO2+I2+2H2O=H2SO4+2HI设计了如下图所示的装置进行实验:
(1)该实验需80ml浓度为5×10-4mol/L的碘
溶液,甲同学应选择 ml的容量瓶进行配制。
(2)广口瓶中使用多孔球泡的目的是 。
(3)在甲同学所配碘溶液浓度准确,并且量取药品及 实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因(至少写两种原因)
II.重量法:乙同学拟用实验室常用仪器组成简易装置测定空气中的SO2含量。实验操作过下:
按如下实验装置图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20ml的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀(H2SO4+BaCl2=BaSO4↓+2HCl),经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.18mg。
(4)取样处空气中SO2含量为 mg/L(精确到0.001)。
(5)现查阅资料知,常温下BaSO3的Ksp为5.48×10-7,饱和亚硫酸溶液中c(SO32-)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.lmol/L BaCl2溶液来吸收SO2即可产生沉淀,你认为这样做 (填“正确”或“不正确”),请利用以上数据简述理由 。
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4。
(6)请写出该电池负极的电极反应式: 。
(14分)
(1)100ml (2分)
(2)多孔球泡有利于气体与溶液的接触面积,有利于充分吸收SO2 气体;(2分)
(3)装置的气密性不好;棉花球不干燥吸收部SO2 气体等;(只要答案合理均可给分);(2分)
(4)0.025 mg (2分)
(5)不正确(2分);因为溶液中 cBa2+ =0.lmol/L,CSO32- 小于6.3×10-8 其乘积小于BaSO3的Ksp
所以不会产生沉淀(2分)
(6)SO2-2e+2H2O=4H++ SO42-(2分)
【解析】
试题分析:抓住本题的关键是测定空气中的SO2含量,分别用氧化还原法、重量法、仪器法来进行测定;
(1)常用的容量瓶容积有100 ml、250 ml、500ml、1000 ml,配置80 ml溶液选用100 ml合适;
(2)增大气体与溶液的接触面积,有利于充分吸收SO2 气体;
(3)只要是引起SO2 没有和碘溶液反应的都会造成所测定的SO2含量仍然比实际含量低;
(4)抽气100次气体体积为2000 ml,即2 L,得到沉淀0.18 mg 根据SO2~H2SO4~BaSO4↓
64 233
X 0.18 mg
X=0.049 mg 则每升空气中SO2含量为0.025 mg
(5)浓度离子积Qc<Ksp 没有沉淀生成;Qc=Ksp 溶液达到沉淀溶解平衡;Qc>Ksp ,溶液有沉淀生成;因为溶液中 cBa2+ =0.lmol/L,CSO32- 小于6.3×10-8 其乘积小于BaSO3的Ksp 所以不会产生沉淀, 溶液有沉淀生成
(6)负极失电子发生氧化反应;
考点:本题以探究实验为基础,考察学生解决生活中的实际问题。以及化学计算、电化学方程式的书写。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
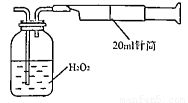 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。