题目内容
【题目】将100mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是( )
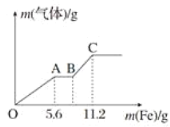
A.原混合酸溶液中H2SO4的浓度为2.0molL-1B.A点对应消耗NO3-物质的量为0.1mol
C.B点对应消耗铁粉的质量为8.4gD.OA段产生的气体是NO,BC段产生的气体是H2
【答案】A
【解析】
A.分析整个反应过程,最后溶液为FeSO4溶液,利用FeSO4中Fe原子与S原子相等,反应消耗Fe的总质量为11.2克,n(Fe)总=0.2mol,故n(H2SO4)=0.2mol,而混酸分成两份进行反应,所以溶液的体积为0.05L,故c(H2SO4)=4 mol·L-1,选项A错误;
B.由方程式Fe+4H++NO3-=Fe3++NO↑+2H2O,再根据消耗的铁为5.6克即铁的物质的量为0.1mol,可以求出消耗的NO3-为0.1mol,选项B正确;
C.由方程式2Fe3++Fe=3Fe2+利用Fe3+可求出生成的Fe2+为0.15mol,再根据Fe原子守恒n(Fe)=n(Fe2+)=0.15mol,所以消耗的铁粉为0.15mol×56g/mol=8.4g,选项C正确;
D.由图象可知Fe与混酸反应发生三个过程O→A为:Fe+4H++NO3-=Fe3++NO↑+2H2O,A→B为:2Fe3++Fe=3Fe2+,B→C为:Fe+2H+=Fe2++H2↑,选项D正确;
答案选A。

 小学课时特训系列答案
小学课时特训系列答案【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D