题目内容
【题目】向一定质量、一定溶质质量分数的稀盐酸中逐滴加入某碳酸钠溶液。实验过程中,产生气体质量与加入碳酸溶液的质量关系如下图所示,试计算:
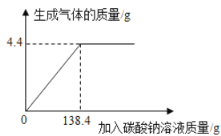
(1)恰好完全反应时,所加碳酸钠溶液中Na2CO3质量是多少?
(2)若恰好完全时所得溶液的溶质质量分数为5%,则稀盐酸的溶质质量分数是多少?
【答案】(1)10.6g;(2) 7.3%。
【解析】
试题分析:(1)根据图示可知产生气体最大值4.4g时盐酸溶液的溶质与138.4g Na2CO3恰好完全反应时。根据方程式:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑可知:106g碳酸钠与73gHCl恰好反应产生44gCO2,则反应产生4.4gCO2水,反应消耗的碳酸钠质量是10.6g;(2)根据方程式:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑可知,恰好完全反应时,反应产生的NaCl的质量是(117÷44)×4.4g=11.7g,所得溶液的质量=11.7g÷5%=234g,稀盐酸的溶夜质量=234g+4.4g-138.4g=100g则稀盐酸的溶质质量分数是(7.3g÷100g)×100%=7.3%。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目


