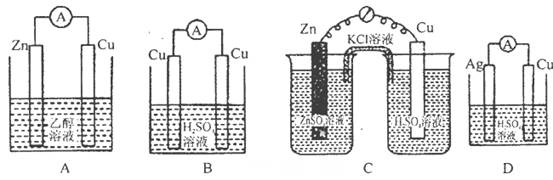
题目内容
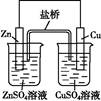
如下图所示的两个实验装置,溶液的体积均为200mL。开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液的体积变化,下列叙述中正确的是
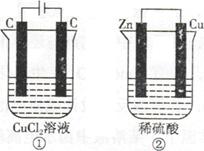

| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上生成物质的质量:①=② |
| D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑ |
B
试题分析:①中阳极发生的反应是2Cl—-2e—=Cl2↑,阴极发生Cu2++ 2e—=Cu,②中Zn极作负极,发生Zn-2e—=Zn2+,Cu极作正极,发生2H++2e—=H2↑,溶质的物质的量均为0.02mol。A、当导线中均通过0.02mol电子时,两装置产生气体体积相等,错误;B、溶液的pH变化:①产生的氯气与水作用使溶液酸性增强,pH减小,②H+浓度减小,使pH增大,正确;C、①产生0.01mol的氯气和0.01mol的铜,②产生0.01mol的氢气,质量不同,错误;D、②中Zn极作负极,发生Zn-2e—=Zn2+,错误,答案选B。

练习册系列答案
相关题目
 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )