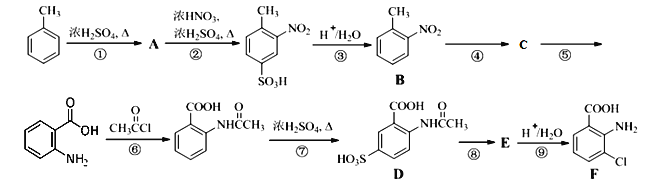
题目内容
【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
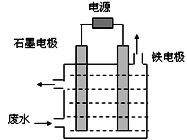
(1)电解处理法:
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。

【答案】 吸热 1.60 CE 阴极 Cl-+2OH--2e-=ClO-+H2O 2CN-+5ClO-+2OH-=N2↑+5Cl-+2CO32-+H2O ![]() b pH太大溶液中发生[4Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以除去
b pH太大溶液中发生[4Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以除去
【解析】试题分析:本题考查外界条件对化学平衡和化学平衡常数的影响,化学平衡常数的计算,电解原理和电极反应式的书写,图像的分析。
I.(1)反应①升高温度,K1增大,升高温度平衡向正反应方向移动,正反应为吸热反应,反应①是吸热反应。
(2)根据化学平衡常数的概念写出平衡常数表达式,K1=c(CO)/c(CO2),K2=c(H2)/c(H2O),K3=![]() =K2/K1,973K时K3=
=K2/K1,973K时K3=![]() =1.60。
=1.60。
(3)A,缩小反应容器的容积,增大压强,反应③的平衡不移动;B,扩大反应容器的容积,减小压强,反应③的平衡不移动;C,1173K时K3=![]() =0.78
=0.78![]() 1.60,升高温度反应③的K3减小,平衡向逆反应方向移动;D,使用合适的催化剂,能加快反应速率缩短达到平衡的时间,不能使化学平衡发生移动;E,设法减小平衡体系中CO浓度,平衡向逆反应方向移动;能使反应③的平衡向逆反应方向移动的措施有C、E,答案选CE。
1.60,升高温度反应③的K3减小,平衡向逆反应方向移动;D,使用合适的催化剂,能加快反应速率缩短达到平衡的时间,不能使化学平衡发生移动;E,设法减小平衡体系中CO浓度,平衡向逆反应方向移动;能使反应③的平衡向逆反应方向移动的措施有C、E,答案选CE。
II.(1)一定条件下电解加入NaCl的含CN-废水时阳极产生ClO-,则阳极为惰性电极,石墨电极为阳极,铁电极为阴极。阳极Cl-失去电子被氧化成ClO-,阳极电极反应为Cl--2e-+2OH-=ClO-+H2O。ClO-将CN-氧化为无害物质,在碱性溶液中CN-被氧化成CO32-和N2,ClO-被还原成Cl-,反应的离子方程式为5ClO-+2CN-+2OH-=5Cl-+2CO32-+N2↑+H2O。
(2)①HCN的电子式为![]() 。
。
②根据图像,pH=7和pH=13总氰去除率低;pH=10和pH=11总氰去除率高;pH选择的最佳范围应为10~11,答案选b。根据资料,[Fe(CN)6]3-转化为CN-容易被H2O2除去,pH太大溶液中发生反应:[Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以转化为CN-而除去。

 考前必练系列答案
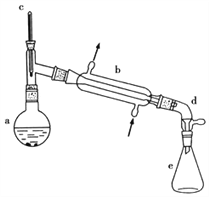
考前必练系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
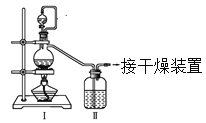
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
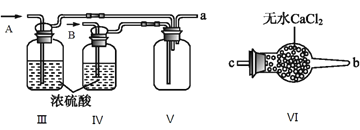
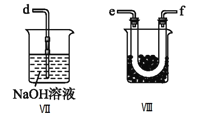
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。