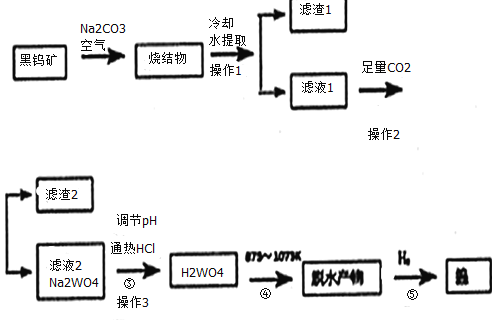
题目内容
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
B. 充电时阳极反应式为2Fe(OH)3+10OH--6e-=2FeO42-+8H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D. 放电时正极附近溶液的碱性减弱
【答案】D
【解析】
A.根据电池反应式知,放电时负极上锌失电子发生氧化反应,所以电极反应式为3Zn-6e-+6OH-=3Zn(OH)2,选项A正确;
B.充电时,阳极电极反应式与放电时正极反应式正好相反,电极反应式为2Fe(OH)3+10OH--6e-=2FeO42-+8H2O,选项B正确;
C.放电时,每转移3 mol电子,正极被还原的K2FeO4的物质的量=![]() =1mol,选项C正确;
=1mol,选项C正确;
D.放电时,正极反应式为2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-,有氢氧根离子生成,则溶液碱性增强,选项D不正确;
答案选D。

练习册系列答案
相关题目