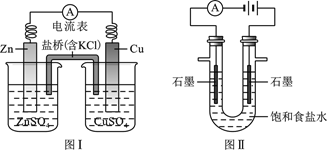
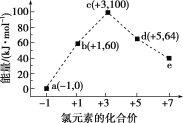
题目内容
【题目】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如下图所示的转化关系:
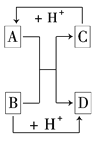
(1)如果A、B、C、D均是10电子的粒子,请写出:
A的电子式_____________;D的电子式____________;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式:____________________________________
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
【答案】
![]() HS-+OH-=S2-+H2O OH- S2-
HS-+OH-=S2-+H2O OH- S2-
【解析】
(1)10电子粒子,原子有Ne(也可看做分子);离子有Na+、Mg2+、Al3+、N3-、O2-、F-、OH-、NH4+、H3O+,分子有CH4、NH3、H2O、HF;
根据图示的转化关系可知,C+H+→A,B+H+→D,A+B→C+D,根据以上的粒子,可推测出A、B、C、D分别为NH4+、OH-、NH3、H2O,据此解题;
(2) 18电子微粒有:Ar、K+、Ca2+、Cl-、S2-、H2O2、F2、HCl、HS-、H2S、PH3、SiH4等。
(1)由分析可知,A的电子式为 ;D的电子式为
;D的电子式为![]() ;
;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,可推测出A、B、C、D分别为HS-、OH-、S2-、H2O。
①A与B在溶液中反应的离子方程式为:HS-+OH-=S2-+H2O;
②弱酸根对应的酸,若酸性越弱,则其与H+结合的能力越强。根据上述离子方程式,可判断酸性HS->H2O ,所以结合质子的能力大小是S2-<OH-。

练习册系列答案
相关题目