题目内容
下列离子方程式正确的是
| A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2 = NO+2NO↑+H2O |
B.NH4HCO3溶液与足量KOH浓溶液共热:NH+OH-  NH3↑+H2O NH3↑+H2O |
| C.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO= 3Fe2++2NO↑+4H2O |
| D.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O |
D
试题分析:A项,氮元素化合价升降总数不相等、电子得失不守恒,且氮原子个数不守恒,二氧化氮与氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,即2OH-+2NO2 = NO+NO2—+H2O,故A选项错误;B项,铵盐与强碱混合加热不是可逆反应,铵根离子与氢氧根离子能反应,碳酸氢根离子与氢氧根离子也能反应,不能漏写,即NH+HCO3-+OH- = CO32-+NH3↑+H2O,故B选项错误;C项,亚铁离子与稀硝酸不能大量共存,易发生氧化还原反应,生成铁离子、一氧化氮和水,即Fe+4H++NO= Fe3++NO↑+2H2O,故C选项错误;硫酸氢钠是强酸酸式盐,能完全电离出钠离子、氢离子和硫酸根离子,具有强酸性,与氢氧化钠中和生成硫酸钠和水,因此反应为OH-+H+= H2O,故D选项正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
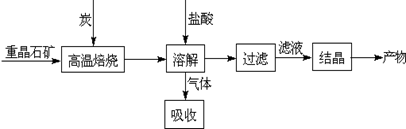
 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
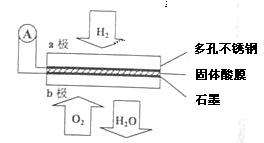
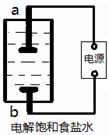
 H2↑+Cl2↑
H2↑+Cl2↑ )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应: + CO2↑+2H2O
+ CO2↑+2H2O CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O