题目内容
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。

(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。

(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
(1)阴极 C12+OH-=C1-+C1O-+H2O
(2)①ClO3-+6I-+6H+=3I2+Cl-+3H2O
②n(NaClO)︰n(NaClO3)=1︰1
③Cl2 ~ 2NaOH
1 2
0.784 L÷22.4 L·mol-1 c(NaOH)×50 mL×10-3
c(NaOH)×50 mL×10-3="2×0.784" L÷22.4 L·mol-1
c(NaOH) =" 1.4" mol·L-1
(2)①ClO3-+6I-+6H+=3I2+Cl-+3H2O
②n(NaClO)︰n(NaClO3)=1︰1
③Cl2 ~ 2NaOH
1 2
0.784 L÷22.4 L·mol-1 c(NaOH)×50 mL×10-3
c(NaOH)×50 mL×10-3="2×0.784" L÷22.4 L·mol-1
c(NaOH) =" 1.4" mol·L-1
试题分析: (1)电解饱和食盐水生成氢氧化钠、氯气和氢气,氯气与氢氧化钠生成氯化钠、次氯酸钠和水。氯气从b电极产生与氢氧化钠溶液反应,a电极为阴极。(2)①ClO3-氧化I-生成Cl-和I2,根据得失电子相等、电荷守恒、质量守恒配平。②ClO-与I-以物质的量比1:2反应生成Cl-和I2,ClO-~2S2O32-;ClO3-与I-以物质的量比1:6反应,ClO3-~6S2O32-,由硫代硫酸钠溶液体积可知ClO-和ClO3-物质的量比为1:1。③氯气与氢氧化钠生成NaCl、NaClO、NaClO3和水,观察生成物可知Na与Cl物质的量比为1:1,0.035molCl2中Cl为0.07mol,所以NaOH物质的量为0.07mol,物质的量浓度为1.4mol/L。

练习册系列答案
相关题目
 Cl2↑+H2↑+ 2OH-
Cl2↑+H2↑+ 2OH- H3O++S2-
H3O++S2- + CO2 +H2O→
+ CO2 +H2O→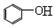 + HCO3-
+ HCO3-
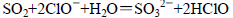


 NH3↑+H2O
NH3↑+H2O