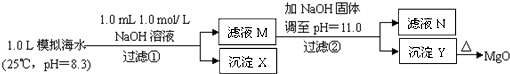
题目内容
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― |
|
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A.沉淀物X为CaCO3 B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
A
【解析】步骤①发生Ca2++OH―+![]()
![]() CaCO3↓+H2O,
CaCO3↓+H2O,
步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。
Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出
A.正确。生成0001 mol CaCO3。
B.错误。剩余c(Ca2+)=0.001 mol/L。
C.错误。c(Mg2+)=5.6×10-6<10-5,无剩余,
D.错误。生成0.05 mol Mg(OH)2,余0.005 mol OH―,
Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出
【评析】本题考察方式很新颖,主要考察溶度积的计算和分析。
解题时要能结合溶度积计算,分析推断沉淀是否产生,要求较高。

(2011?浙江)海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
|
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备Mg0的实验方案( )
已知:Kap[Mg(OH)4]=5.61×10-12 下列说法正确的是( ) |