题目内容
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
D
解析试题分析:根据电解池原理知,要让电解后的电解质复原,遵循的原则是:出什么加什么。Cu(OH)2从组成上可看成CuO?H2O,加入0.2 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则硫酸铜溶液电解完成后,又电解了0.2 mol H2O,由电解的总反应式2H2O+2CuSO4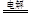 2Cu+O2↑+2H2SO4 知,0.2mol硫酸铜电解转移电子0.4mol ,2H2O
2Cu+O2↑+2H2SO4 知,0.2mol硫酸铜电解转移电子0.4mol ,2H2O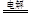 2H2↑+O2↑0.2mol水电解转移电子0.4mol,所以电解过程中共转移电子为0.8mol,选D。
2H2↑+O2↑0.2mol水电解转移电子0.4mol,所以电解过程中共转移电子为0.8mol,选D。
考点:考查电解原理。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应)。白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。下列说法正确的是( )
| A.在使用过程中此电池要不断补充水 |
| B.放电时NiOOH在电极上发生氧化反应 |
| C.充电时阴极区电解质溶液pH升高 |
| D.充电时阴极反应为Ni(OH)2-e-+OH-= NiOOH+H2O |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
下列叙述正确的是
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH |
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol/LKOH溶液,下列说法中正确的是
| A.放电时K+移向负极 |
| B.放电时电池负极的电极反应为H2-2e-=2H+ |
| C.放电时电池正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.该电池充电时将碳电极与电源的正极相连 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
