题目内容
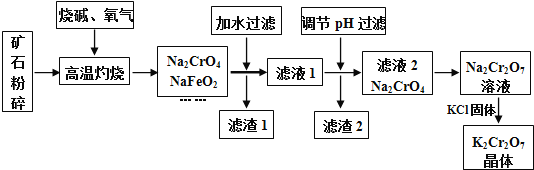
【题目】重铬酸钾![]() 是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备.铬铁矿中通常含有
是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备.铬铁矿中通常含有![]() 、FeO、
、FeO、![]() 、
、![]() 等.
等.
已知:①![]() 遇水强烈水解.
遇水强烈水解.
②![]() 黄色
黄色![]() 橙色
橙色![]()
请回答下列问题:
(1)将矿石粉碎的目的是 ______ ;高温灼烧时![]() 发生反应的化学方程式为 ______ .
发生反应的化学方程式为 ______ .
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式 ______ ![]() 滤渣2的主要成分是
滤渣2的主要成分是![]() 和 ______ .
和 ______ .
(3)用简要的文字说明![]() 溶液中加入KCl固体,降温析出
溶液中加入KCl固体,降温析出![]() 的原因 ______ .
的原因 ______ .
(4)![]() 时,对反应
时,对反应![]() 黄色
黄色![]() 橙色
橙色![]() ,取
,取![]() 溶液进行实验,测得部分实验数据如下:
溶液进行实验,测得部分实验数据如下:
时间 | 0 |
|
|
|
|
|
|
|
|
| |
| 0 |
|
|
|
①反应达到平衡时,溶液的![]() ,该反应平衡常数K为 ______ .
,该反应平衡常数K为 ______ .
②下列有关说法正确的 ______ .
![]() 加少量
加少量![]() 固体,可使溶液的橙色加深
固体,可使溶液的橙色加深
![]() 时
时![]()
![]() 溶液中
溶液中![]() :
:![]() :1时该反应已达平衡状态
:1时该反应已达平衡状态
![]() 反应达到平衡时
反应达到平衡时![]() 的转化率为
的转化率为![]()
【答案】增大反应物的表面积,加快反应速率 
![]()
![]()
![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小 ![]() bd
bd
【解析】
铁矿中通常含有![]() 、FeO、
、FeO、![]() 、
、![]() 等,将铬铁矿和烧碱、氧气混合焙烧得到
等,将铬铁矿和烧碱、氧气混合焙烧得到![]() 、
、![]() ,而
,而![]() 与NaOH发生反应生成
与NaOH发生反应生成![]() ,
,![]() 与NaOH发生反应,生成
与NaOH发生反应,生成![]() ,故还含有
,故还含有![]() 、
、![]() ,由于
,由于![]() 会发生强烈水解,滤渣1中有红褐色物质,可推知
会发生强烈水解,滤渣1中有红褐色物质,可推知![]() 水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是
水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是![]() 、
、![]() 、
、![]() 、NaOH,滤渣1为
、NaOH,滤渣1为![]() ;调节溶液pH,使
;调节溶液pH,使![]() 、
、![]() 反应转化为
反应转化为![]() 、
、![]() 沉淀,过滤除去,滤液2主要是
沉淀,过滤除去,滤液2主要是![]() ,加入硫酸酸化,溶质变为
,加入硫酸酸化,溶质变为![]() ,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到
,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到![]() 晶体,采用过滤方法得到
晶体,采用过滤方法得到![]() 晶体,
晶体,
![]() 增大反应物的表面积,加快反应速率;发生氧化还原反应,
增大反应物的表面积,加快反应速率;发生氧化还原反应,![]() 与
与![]() 、NaOH反应生成
、NaOH反应生成![]() 与水;
与水;
![]() 会发生强烈水解生成氢氧化钠与氢氧化铁;滤渣2的主要成分是氢氧化铝与硅酸;
会发生强烈水解生成氢氧化钠与氢氧化铁;滤渣2的主要成分是氢氧化铝与硅酸;
![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
![]() 时
时![]() ,与
,与![]() 时的浓度相等,故
时的浓度相等,故![]() 时处于平衡状态,再根据
时处于平衡状态,再根据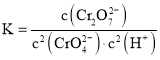 计算;
计算;
![]() 加少量
加少量![]() 固体,消耗氢离子,平衡逆向移动;
固体,消耗氢离子,平衡逆向移动;
![]() 时处于平衡状态,不同物质表示的正逆速率之比等于其化学计量数之比;
时处于平衡状态,不同物质表示的正逆速率之比等于其化学计量数之比;
![]() 平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关;
平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关;
![]() 转化率
转化率![]() 。
。
铁矿中通常含有![]() 、FeO、
、FeO、![]() 、
、![]() 等,将铬铁矿和烧碱、氧气混合焙烧得到
等,将铬铁矿和烧碱、氧气混合焙烧得到![]() 、
、![]() ,而
,而![]() 与NaOH发生反应生成
与NaOH发生反应生成![]() ,
,![]() 与NaOH发生反应,生成
与NaOH发生反应,生成![]() ,故还含有
,故还含有![]() 、
、![]() ,由于
,由于![]() 会发生强烈水解,滤渣1中有红褐色物质,可推知
会发生强烈水解,滤渣1中有红褐色物质,可推知![]() 水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是
水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是![]() 、
、![]() 、
、![]() 、NaOH,滤渣1为
、NaOH,滤渣1为![]() ;调节溶液pH,使
;调节溶液pH,使![]() 、
、![]() 反应转化为
反应转化为![]() 、
、![]() 沉淀,过滤除去,滤液2主要是
沉淀,过滤除去,滤液2主要是![]() ,加入硫酸酸化,溶质变为
,加入硫酸酸化,溶质变为![]() ,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到
,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到![]() 晶体,采用过滤方法得到
晶体,采用过滤方法得到![]() 晶体,
晶体,
![]() 将矿石粉碎的目的是:增大反应物的表面积,加快反应速率;发生氧化还原反应,
将矿石粉碎的目的是:增大反应物的表面积,加快反应速率;发生氧化还原反应,![]() 与
与![]() 、NaOH反应生成
、NaOH反应生成![]() 与水,反应方程式为:
与水,反应方程式为: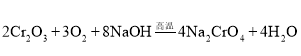 ,
,
故答案为:增大反应物的表面积,加快反应速率;![]() ;
;
![]() 会发生强烈水解生成氢氧化钠与氢氧化铁,反应离子方程式为:
会发生强烈水解生成氢氧化钠与氢氧化铁,反应离子方程式为:![]() ;滤渣2的主要成分是
;滤渣2的主要成分是![]() 和
和![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 溶液中加入KCl固体,降温析出
溶液中加入KCl固体,降温析出![]() 的原因:
的原因:![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,
故答案为:![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
![]() 时
时![]() ,与
,与![]() 时的浓度相等,故
时的浓度相等,故![]() 时处于平衡状态,反应达到平衡时,溶液的
时处于平衡状态,反应达到平衡时,溶液的![]() ,该反应平衡常数
,该反应平衡常数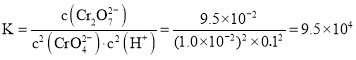 ,
,
故答案为:![]() ;
;
![]() 加少量
加少量![]() 固体,消耗氢离子,平衡逆向移动,溶液的橙色变浅,黄色加深,故a错误;
固体,消耗氢离子,平衡逆向移动,溶液的橙色变浅,黄色加深,故a错误;
![]() 时处于平衡状态,
时处于平衡状态,![]() 说明同种离子的生成熟练与消耗熟练相等,故b正确;
说明同种离子的生成熟练与消耗熟练相等,故b正确;
![]() 平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关,故c错误;
平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关,故c错误;
![]() 反应达到平衡时
反应达到平衡时![]() 的转化率为:
的转化率为:![]() ,故d正确;
,故d正确;
故答案为:bd。