题目内容
5.实验室常用的浓盐酸密度为1.17g•mL-1,物质的量浓度为11.7mol/L,(1)取此浓盐酸50mL,用蒸馏水稀释至200mL后稀盐酸的物质的量浓度?
(2)将13g锌投入上述实验所得稀盐酸中,充分反应,求:放出的H2在标准状况下的体积;
(3)此浓盐酸中HCl的质量分数?
分析 (1)根据稀释定律c1V1=c2V2计算稀释后盐酸的浓度;
(2)根据n=$\frac{m}{M}$计算n(Zn),再根据方程式Zn+2HCl=ZnCl2+H2↑计算;
(3)根据c=$\frac{1000ρw}{M}$计算.
解答 解:(1)由c1V1=c2V2可知,稀释后盐酸的浓度为$\frac{0.05L×11.7mol/L}{0.2L}$=2.925 mol/L,答:用蒸馏水稀释至200mL后稀盐酸的物质的量浓度2.925 mol/L;
(2)13gZn的物质的量为$\frac{13g}{65g/mol}$=0.2mol,由Zn+2HCl=ZnCl2+H2↑,可知n(H2)=n(Zn)=0.2mol,故V(H2)=22.4L•mol-1×0.2mol=4.48L,
答:标况下生成氢气的体积为4.48L;
(3)浓盐酸密度为1.17g•mL-1,物质的量浓度为11.7mol/L,11.7mol/L=$\frac{1000×1.17×w}{36.5}$,解之得:w=36.5%,答:盐酸中HCl的质量分数为36.5%.
点评 本题考查方程式的有关计算,为高频考点,把握发生的反应及物质的量为中心的基本计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列化学用语表示正确的是( )
| A. | N2的电子式: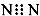 | B. | 钠离子的结构示意图: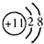 | ||
| C. | 乙烯的结构式:C2H4 | D. | CO2的比例模型: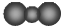 |
16.下列实验操作中正确的是( )
| A. | 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 | |
| B. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| C. | 向试管中加入液体时,应将胶头滴管紧贴试管内壁 | |
| D. | 称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 |
13.通常情况下加入氧化剂能实现的变化是( )
| A. | MnO2→MnSO4 | B. | Na2O2→O2 | C. | KI→KIO3 | D. | AlCl3→Al(OH)3 |
20.下列实验能达到预期目的是( )
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向乙酸乙酯中加入NaOH溶液再蒸馏,提纯乙酸乙酯 |
10.下列说法正确的是( )
| A. | 没有氧元素参加的反应一定不是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 有单质生成的分解反应一定是氧化还原反应 |
17.下列反应无论怎样调整反应物的用量,都只能生成纯净物的是( )
| A. | 甲烷和氯气混合后光照发生反应 | B. | 乙烯与氯化氢的加成反应 | ||
| C. | 丙烯的加聚反应 | D. | 乙炔和氯气的加成反应 |
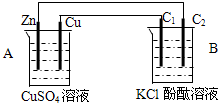 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题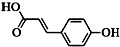 )主要用于制备香辛樱桃、杏、蜂蜜等香料.
)主要用于制备香辛樱桃、杏、蜂蜜等香料.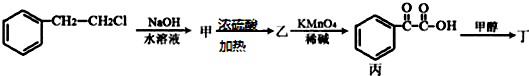
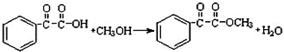
 (任写一个即可).
(任写一个即可).