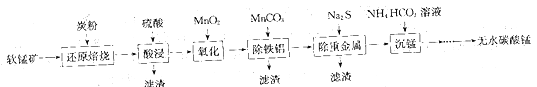
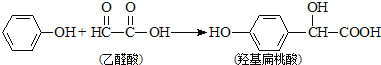题目内容
【题目】下表是元素周期表的一部分,用化学用语回答:
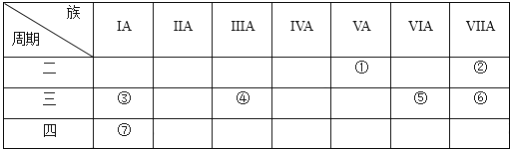
(1)②的元素符号为_________。
(2)比较元素③和⑦的原子半径大小:③_____⑦(填“>”或“<”)。
(3)绘出元素⑤的离子结构示意图_________________。
(4)元素①的氢化物的电子式为____________,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为___________________________________。
【答案】 F < 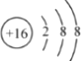
![]() Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
【解析】根据元素在周期表中的位置可知,①为N元素,②为F元素,③为Na元素,④为Al元素,⑤为S元素,⑥为Cl元素,⑦为K元素。
(1)②的元素符号为F,故答案为:F;
(2)同一主族从上到下,原子半径逐渐增大,元素③和⑦的原子半径大小:③<⑦,故答案为:<;
(3)元素⑤为S元素,为16号元素,离子结构示意图为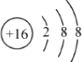 ,故答案为:
,故答案为: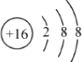 ;
;
(4)元素①的氢化物的电子式为![]() ,将氨气通入氯化铝的水溶液中,反应生成氢氧化铝沉淀,反应的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+,故答案为:
,将氨气通入氯化铝的水溶液中,反应生成氢氧化铝沉淀,反应的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+,故答案为:![]() ;Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+。
;Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+。

 口算能手系列答案
口算能手系列答案【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH) :n(O2)=2 :3
c.容器内密度保持不变
d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),通入氧气的一极的电极反应式为_______________。