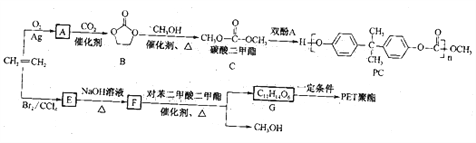
题目内容
【题目】碳酸锰(MnCO3)常用于脱硫的催化剂。工业上利用软锰矿(主要成分是MnO2,还含有钙、铁、铝镁的氧化物及一些重金属的氧化物)制备无水碳酸锰的工艺流程如下:
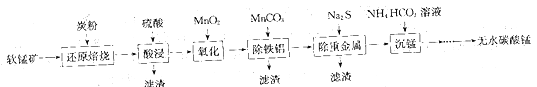
回答下列问题:
(1)为了提高“酸浸”步骤中原料的浸出率,可以采取的措施有___________(填字母)。
a.适当升温 b.连续搅拌 c.研磨矿石 d.加入足量的水
(2)“氧化”步骤中利用MnO2将溶液中Fe2+氧化为Fe3+,反应的离子方程式为_____________。
(3)“除铝铁”步骤中用MnCO3调节溶液pH的优点是___________________(写出一点),也可以用(填化学式)_____________代替MnCO3。
(4)“沉锰”步骤中反应温度需要控制在30~35℃以下,反应温度控制在35℃以下的原因是____,写出“沉锰”步骤中发生反应的化学方程式:________________________。
(5)25℃时,Ksp(MnCO3)=2.2×10-11,Ksp(MgCO3)=6.8×10-6。“沉锰”步骤中当Mn2+刚好沉淀完全[c(Mn2+)=1×10-5mol·L-1]时,若不析出MgCO3沉淀,则此时c(Mg2+)不能超过_____________mol·L-1(计算结果保留1位小数)。
【答案】 abc MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 不引入新的杂质(或增加碳酸锰的产量) Mn(OH)2 减少碳酸氢铵的分解,提高原料利用率 MnSO4+2NH4HCO3![]() MnCO3↓+(NH4)2SO4+CO2↑+H2O 3.1
MnCO3↓+(NH4)2SO4+CO2↑+H2O 3.1
【解析】(1)搅拌固体和液体的混合物,升高温度、搅拌和增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有适当升温、连续搅拌、研磨矿石等,加水是稀释,速率降低,故答案为abc;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)“除铝铁”步骤中用MnCO3调节溶液pH既能降低H+的浓度,又不引入新的杂质,同时还能增加碳酸锰的产量,根据除杂原则,也可以用 Mn(OH)2 代替MnCO3;
(4)“沉锰”步骤中需要滴加碳酸氢铵溶液,因碳酸氢铵不稳定,受热易分解,则反应温度控制在35℃以下,以减少碳酸氢铵的分解,提高原料利用率;本操作步骤中可获得MnCO3沉淀,同时生成(NH4)2SO4和CO2,根据原子守恒可得此反应的化学方程式为MnSO4+2NH4HCO3![]() MnCO3↓+(NH4)2SO4+CO2↑+H2O ;
MnCO3↓+(NH4)2SO4+CO2↑+H2O ;
(5)已知Ksp(MnCO3)=c(Mn2+)×c(CO32-)=2.2×10-11,当c(Mn2+)=1×10-5mol·L-1时,c(CO32-)=2.2×10-6mol·L-1,则Ksp(MgCO3)=c(Ca2+)×c(CO32-)=6.8×10-6,c(Ca2+)=3.1mol·L-1。