题目内容
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH) :n(O2)=2 :3
c.容器内密度保持不变
d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),通入氧气的一极的电极反应式为_______________。
【答案】 热 0.015mol·L-1·min-1 ad 负 O2 + 4H+ + 4e- = 2H2O
【解析】(1)由据图可知,太阳能首先转化为化学能,其次化学能转化为热能,故答案为:热;
(2)①用CH3OH表示0~3 min内该反应的平均反应速率为![]() =
=![]() =0.015mol·L-1·min-1,故答案为:0.015mol·L-1·min-1;
=0.015mol·L-1·min-1,故答案为:0.015mol·L-1·min-1;
②a.v正(H2O)=2v逆(CO2)表示正逆反应速率相等,说明反应已达到平衡状态,正确;b.n(CH3OH) :n(O2)=2 :3,不能说明物质的量是否变化,因此不能说明反应已达到平衡状态,错误;c.容器的体积不变,气体的质量不变,容器内气体的密度始终保持不变,不能说明反应已达到平衡状态,错误;d.该反应属于气体的物质的量发生变化的反应,容器内压强保持不变,说明反应已达到平衡状态,正确;故选ad;
(3)甲醇、氧气和稀硫酸制作燃料电池,甲醇应通入该燃料电池的负极,负极电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O;通入氧气的一极为正极,电极反应式为O2 + 4H+ + 4e- = 2H2O,故答案为:负;O2 + 4H+ + 4e- = 2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ (1)下列实验操作或叙述正确的是_________(填字母)
A.向饱和苯酚钠溶液中,不断通入足量二氧化碳气体,溶液最终呈浑浊
B.用金属钠检验无水乙醇中含有的少量水
C.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯
D.向苯酚浓溶液中滴入少量浓溴水可观察到白色的三溴苯酚沉淀
E.只用水就能鉴别苯、硝基苯、乙醇
F.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
H.甲醛与苯酚制取酚醛树脂的反应属于缩聚反应
I.在蔗糖的水解液中加新制Cu(OH)2悬浊液,有砖红色沉淀生成
Ⅱ. 1—乙氧基萘常用作香料,也可合成其他香料。实验室制备1—乙氧基萘的过程如下:
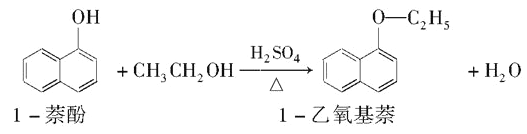
已知:1—苯酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数如下:
物质 | 相对分子质量 | 状态 | 熔点 (℃) | 沸点 (℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(1) 将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应(加热装置和其它加持装置未画出)。实验中使用过量乙醇的原因是____________________。

(2)装置a的作用是________________。
(3)反应结束,将三颈烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;
A.③②④① B.①②③④ C.②①③④
(4)蒸馏时应该选择_________(选填编号),操作中应控制的关键实验条件为________________。

(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因是____________________。

(6)用金属钠可检验1—乙氧基萘是否纯净,简述实验现象与结论:_______________。
(7)提纯的产品经测定为73.1g,本实验中1—乙氧基萘的产率为________________。
【题目】如表是A、B、C三种烃的有关信息;
A | B | C |
①能使溴的四氯化碳溶液褪色; ②比例模型为:
| ①平面型结构 ②棍模型为: | ①能使溴的四氯化碳溶液褪色; ②1mol能与2molH2在一定条件下反应生成A ③比例模型为: |
|
图2 |
根据表中信息回答下列问题:
(1)写出烃A与水反应的化学反应方程式_____________________;
(2)烃B分子碳碳键具有的特点是_______________________
(3)如图1是烃B与液溴制取溴苯的装置,试回答:
(a)装置C中的现象___________________________________.
(b)装置B的作用__________________________________.
(4)如图2是制取烃C的装置,试回答:
(a)为了控制生成乙炔的速率,分液漏斗中盛放的液体是_______________。
(b)滴下液体后烧瓶中发生反应生成乙炔,写出此反应的化学方程式:_________。
(c)电石中含有硫化钙杂质,产生H2S,PH3等气体,为了不对乙炔性质造成干扰,应该除杂,一般选用___________洗气。