��Ŀ����
����Ŀ����һ�ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2 �� ��һ�������·������·�Ӧ��N2��g��+3H2��g��2NH3��g ����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ�� 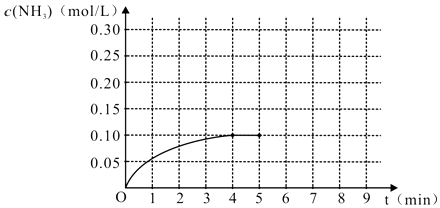
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v��NH3��Ϊ ��
��2����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ ��
A.0.20mol/L
B.0.12mol/L
C.0.10mol/L
D.0.08mol/L
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬��ֻ�������������Сһ�룬ƽ���ƶ�������淴Ӧ������������Ӧ��������
���𰸡�
��1��0.025mol/��L?min��
��2��AC
��3������Ӧ����
���������⣺��1����ͼ��֪��4min�ﵽƽ�⣬0��4min���ɰ���Ϊ0.10mol/L��ƽ����Ӧ����v��NH3��= ![]() =0.025 mol/��Lmin����
=0.025 mol/��Lmin����
���Դ��ǣ�0.025 mol/��Lmin������2����ƽ�������Ũ��Ϊ0.10mol/L����5����ĩ�����������������䣬�÷�ӦΪ���ȷ�Ӧ��
�������¶ȣ�ƽ�������ƶ���������Ũ������Ϊ���淴Ӧ��������ȫת������֪0.10mol/L��c��NH3����0.2mol/L��
�������¶ȣ�ƽ�������ƶ���������Ũ�ȼ�С����֪0��c��NH3����0.1mol/L��
��NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L��0.1mol/L��
���Դ��ǣ�AC����3��ƽ����������������䣬��ֻ�������������Сһ�룬��ѹǿ���÷�ӦΪ���������С�ķ�Ӧ����֪ѹǿ����ƽ��������Ӧ�����ƶ���
���Դ��ǣ�����Ӧ����
�����㾫�������ջ�ѧƽ��״̬���ʼ������ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�