��Ŀ����
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飺
����̽��ͬ����Ԫ�����ʵĵݱ����
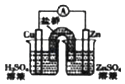
��1����ͬ�����£����ơ�þ������1 mol�ֱ�Ͷ�뵽������ͬŨ�ȵ�ϡ�����У���Ԥ��ʵ������_______��ϡ���ᷴӦ����ң�______��ϡ���ᷴӦ������������ࡣ
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ_____________________________��
����̽��ͬ����Ԫ�طǽ����Եĵݱ����
ij�о���ѧϰС�������һ��ʵ����̽����A��Ԫ��ԭ�ӵĵõ�������ǿ�����ɡ���ͼ��A��B��C�������ɹ�ѡ����ȡ������װ�ã�װ��D�IJ������Т����ڴ����η���պ��NaBr��Һ��NaOHŨ��Һ������
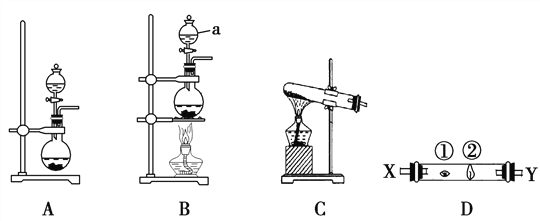
��3��д��װ��B������a������ ________________��
��4��ʵ������ȡ�������ɲ�������ԭ����2KMnO4��16HCl(Ũ)===2KCl��2MnCl2��5Cl2����8H2O�����ݸ÷�Ӧԭ��ѡ��_____________���A������B����C����װ����ȡ������
��5����Ӧװ�õĵ���������װ��D��X���ܣ��Իش��������⣺
�ٴ�������Ӧ�����ӷ���ʽΪ________________________________��
�ڴ�������Ӧ�����ӷ���ʽΪ________________________________��
���𰸡� �ƣ���Na�� ������Al�� S2����Cl2=2Cl����S�� ��Һ©�� A Cl2��2Br��===2Cl����Br2 Cl2��2OH��===Cl����ClO����H2O
����������1������������˳��Ϊ���ƣ�þ������������ͬ�����������ᷴӦ��ҵ����ƣ���Ӧ��������������������1mol������Ҫ�õ�2mol���ӣ�1mol�ƶ�ʧȥ1mol���ӣ�1molþʧȥ2mol���ӣ���1mol��ʧȥ3mol���ӣ������������������ǽ�������
�ʴ�Ϊ����������
��2������������ǿ�����ʣ����������ܹ��������ӷ�Ӧ������Ӧ�����ӷ���ʽΪ��S2-+Cl2�TS��+2Cl-���ʴ�Ϊ��S2-+Cl2�TS��+2Cl-��
��(3)��ͼ֪aΪ��Һ©����������ȷ����:��Һ©��;
(4)���������Ũ���ᷴӦ��Ϊ����,������ȼ��ɽ���,��ˣ�������ȷ����:A;
(5)��������������ʱ,������ͨ��NaOH��Һ,�������������,����β�����յ�����, ��Ϊ����ΪNaBr��Һ������ΪNaOH��Һ������Ӧ��X�˽�������
��������NaBr��Һ��Ӧ����Br2,��Ӧ�����ӷ���ʽΪCl2��2Br��===2Cl����Br2 ,
����������ΪNaOH��Һ��Ӧ�������ӷ�Ӧ����ʽΪ Cl2��2OH��===Cl����ClO����H2O���𰸣�Cl2��2Br��===2Cl����Br2 Cl2��2OH��===Cl����ClO����H2O

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�����Ŀ���±����и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת�����ǣ� ��
ѡ�� | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A.A
B.B
C.C
D.D