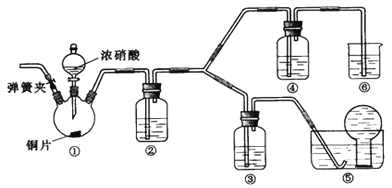
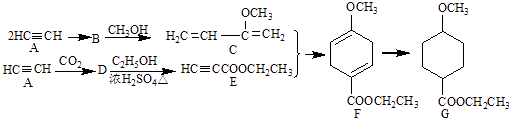��Ŀ����
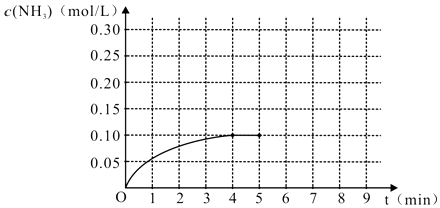
����Ŀ�����淴Ӧ2A��g��+3B��g��4C��g��+D��g������֪��ʼŨ��c��A��=4molmol��1 �� c��B��=3molmol��1 �� C��DŨ�Ⱦ�����0����Ӧ��ʼ2���ﵽƽ��״̬����ʱD��ƽ��Ũ��Ϊ0.5molL��1 �� ������˵������ȷ���ǣ� ��
A.��Ӧ����v��C��=1molL��1s��1
B.C��ƽ��Ũ��Ϊ4 molL��1
C.A��ת����Ϊ25%
D.B��ƽ��Ũ��Ϊ1.5 molL��1
���𰸡�B
���������⣺��������ʽ�����㣺
2A��g�� | + | 3B��g�� | 4C��g�� | + | D��g�� | ||
��ʼ��mol/l�� | 4 | 3 | 0 | 0 | |||
ת����mol/l�� | 1 | 1.5 | 2 | 0.5 | |||
ƽ�⣨mol/l�� | 3 | 1.5 | 2 | 0.5 |
A����Ӧ����v��C��= ![]() =1mol/��L��s������A��ȷ��
=1mol/��L��s������A��ȷ��
B��C��ƽ��ΪŨ��Ϊ2mol/L����B����
C��A��ת����Ϊ ![]() =25%����C��ȷ��
=25%����C��ȷ��
D��B��ƽ��Ũ��Ϊ1.5mol/L����D��ȷ��
��ѡB��
�����㾫����������Ҫ�����˻�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮

��ϰ��ϵ�д�
�����Ŀ