题目内容
【题目】苯酚是一种重要的化工原料.以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)
(1)由苯酚生成A的化学方程式是 .
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种,与C含有相同官能团的同分异构共有种,C的结构简式是;
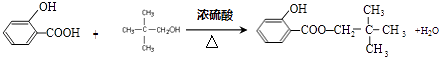
(3)B与C反应的化学方程式是 .
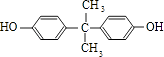
(4)由苯酚生成D的化学方程式是由D生成N的反应类型是
(5)以苯酚为基础原料也可以合成防腐剂F.经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,F完全燃烧只生成CO2和H2O.则F的分子式是 . 已知:①芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“﹣O﹣O﹣”的连接方式.F的结构简式是 .
【答案】
(1)![]() +NaOH→
+NaOH→ ![]() +H2O
+H2O
(2)7;![]()
(3)
(4)2 ![]() +
+ ![]()
![]() ?
?  +H2O;聚反应
+H2O;聚反应
(5)C8H8O3;![]()
【解析】解:苯酚与氢氧化钠反应生成苯酚钠,故A为 ![]() ,由转化关系可知B为
,由转化关系可知B为 ![]() ,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是
,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是 ![]() ,B与C发生酯化反应生成M,则M为
,B与C发生酯化反应生成M,则M为 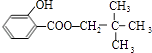 .苯酚与丙酮反应生成D,D的分子式为C15H16O2 , 再结合N的结构可知D为
.苯酚与丙酮反应生成D,D的分子式为C15H16O2 , 再结合N的结构可知D为 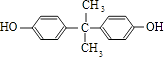 .(1)苯酚与氢氧化钠反应生成苯酚钠,反应方程式为:
.(1)苯酚与氢氧化钠反应生成苯酚钠,反应方程式为: ![]() +NaOH→
+NaOH→ ![]() +H2O,所以答案是:
+H2O,所以答案是: ![]() +NaOH→
+NaOH→ ![]() +H2O;(2)C的结构简式是
+H2O;(2)C的结构简式是 ![]() ,与C含有相同官能团的同分异构,可以看作戊烷被羟基取代,正戊烷被羟基取代有3种,异戊烷被羟基取代有4种,新戊烷被羟基取代得到C,不含C共有7种,所以答案是:7;
,与C含有相同官能团的同分异构,可以看作戊烷被羟基取代,正戊烷被羟基取代有3种,异戊烷被羟基取代有4种,新戊烷被羟基取代得到C,不含C共有7种,所以答案是:7; ![]() ;(3)B与C反应的化学方程式是:
;(3)B与C反应的化学方程式是: 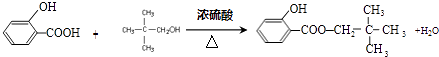 ,所以答案是:
,所以答案是:  ;(4)由苯酚生成D的化学方程式是:2
;(4)由苯酚生成D的化学方程式是:2 ![]() +
+ ![]()
![]()
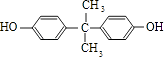 +H2O;生成N的反应类型是缩聚反应 所以答案是:2
+H2O;生成N的反应类型是缩聚反应 所以答案是:2 ![]() +
+ ![]()
![]()
 +H2O;缩聚反应;(5)以苯酚为基础原料也可以合成防腐剂F.经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,则分子中氧原子数目为
+H2O;缩聚反应;(5)以苯酚为基础原料也可以合成防腐剂F.经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,则分子中氧原子数目为 ![]() =3,芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应,故分子中含有苯环、﹣COOH,假定为二元取代,则剩余基团的相对分子质量为152﹣76﹣45=31,且含有1个O原子,完全燃烧只生成CO2和H2O,故剩余基团为﹣OCH3或﹣CH2OH,故F的分子式为C8H8O3 , F的核磁共振氢谱显示其分子中含有4种氢原子,分子结构中不存在“﹣O﹣O﹣”的连接方式,F的结构简式是
=3,芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应,故分子中含有苯环、﹣COOH,假定为二元取代,则剩余基团的相对分子质量为152﹣76﹣45=31,且含有1个O原子,完全燃烧只生成CO2和H2O,故剩余基团为﹣OCH3或﹣CH2OH,故F的分子式为C8H8O3 , F的核磁共振氢谱显示其分子中含有4种氢原子,分子结构中不存在“﹣O﹣O﹣”的连接方式,F的结构简式是 ![]() ,所以答案是:C8H8O3 ,
,所以答案是:C8H8O3 , ![]() .
.

【题目】锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.
(1)Ⅰ锂的原子结构示意图为;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式 .
(2)Ⅱ下面是从锂辉石(Li2OAl2O3SiO2)中提出锂的工业流程示意图.
①高温煅烧时的反应原理为:
Li2OAl2O3SiO2+K2SO4═K2OAl2O3SiO2+Li2SO4
Li2OAl2O3SiO2+Na2SO4═Na2OAl2O3SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ .
③几种金属离子沉淀完全的pH
金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
温度 | 10℃ | 20℃ | 50℃ | 80℃ |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
a.浸取时使用冷水的原因是 .
b.滤渣2的主要成分为 .
c.流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是 , 用离子方程式表示其产生的原因 .
d.加热浓缩的作用是 .
e.洗涤Li2CO3晶体使用 .