题目内容
14.碳、氮、氧是地球上含量丰富的元素.(1)C、N、O的第一电离能由大到小的顺序为N、O、C (用元素符号表示).
(2)前四周期元素中,基态原子未成对电子数与氮相同的元素有4种.
(3)试判断NH3溶于水后,形成NH3•H2O的合理结构B (填字母代号).
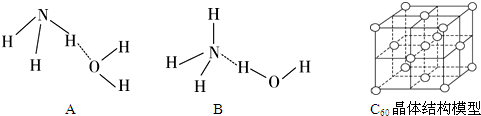
(4)H2O分子与H+结合的过程中未发生改变的是B (填序号).
A.微粒的空间构型 B.氧原子的杂化方式 C.H-O-H的键角
(5)C60晶体(其结构模型如图,图中○为C60)中每个C60分子周围与它距离最近且等距离的C60分子有6个.
(6)(CN)2的结构式为N≡C-C≡N,该分子中σ键和π键数目之比为3:4.
分析 (1)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,据此答题;
(2)基态原子氮有三个未成对的电子,根据原子核外电子排布可知,在前四周期中有三个未成对电子的原子有磷、砷、钒、钴四种元素,据此答题;
(3)氨水的电离生成NH4+、OH-,说明NH3•H2O 中O-H键发生断裂,来确定氨水的结构和成键情况;
(4)H2O分子是V型,H3O+是三角锥型,键角不同,二者O原子杂化轨道数目相同,都采取sp3杂化;
(5)根据晶胞的结构可知,以晶胞体心的分子为例,周围与它距离最近且等距离的C60分子分布在晶胞六个面的面心上,据此答题;
(6)根据(CN)2的结构式为N≡C-C≡N,单键中都是σ键,参键中有2个π键和1个σ键,据此答题;
解答 解:(1)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,
故答案为:N、O、C;
(2)基态原子氮有三个未成对的电子,根据原子核外电子排布可知,在前四周期中有三个未成对电子的原子有磷、砷、钒、钴四种元素,
故答案为:4;
(3)NH3溶于水后,形成的NH3•H2O中,NH3•H2O的电离方程式为NH3•H2O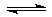
故答案为:B;
(4)H2O分子是V型,H3O+是三角锥型,键角不同,二者O原子杂化轨道数目相同,都采取sp3杂化,
故答案为:B;
(5)根据晶胞的结构可知,以晶胞体心的分子为例,周围与它距离最近且等距离的C60分子分布在晶胞六个面的面心上,故有6个,
故答案为:6;
(6)根据(CN)2的结构式为N≡C-C≡N,单键中都是σ键,参键中有2个π键和1个σ键,所以分子中σ键和π键数目之比为3:4,
故答案为:3:4.
点评 本题主要考查了第一电离能、原子结构、氢键、晶胞结构等知识,难度不大,都是对基础知识的考查.

H2(g)+S(s)?H2S(g),K1;
S(s)+O2(g)?SO2(g),K2.
则反应:H2(g)+SO2(g)?O2(g)+H2S(g)的平衡常数为( )
| A. | K1+K2 | B. | K-K2 | C. | K1×K2 | D. | $\frac{{K}_{1}}{{K}_{2}}$ |
| A. | 蛋白质 | B. | 食醋 | C. | 淀粉 | D. | 花生油 |
| A. | 离子晶体中肯定不含共价键 | B. | 离子晶体都易溶于水 | ||
| C. | 分子晶体的熔、沸点一般较低 | D. | 原子晶体键长越大,键能越大 |
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e+=Fe3+,继而形成铁锈 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的负极相连接,正极连接到一个废铁上可防止水闸被腐蚀 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4中含有的C原子数目为NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,所含Cl-个数为NA |
| A. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
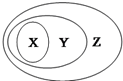 X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是
X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是