题目内容
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
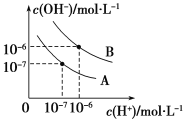
(1)25 ℃时,将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=________。
(2)95 ℃时,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合(假设溶液的体积变化忽略不计),所得混合液的pH=________。
(3)25 ℃时Ksp(AgCl)=1.8×10-10,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸(假设溶液的体积变化忽略不计),混合后溶液中Ag+的浓度为________ mol·L-1,pH为________。
(4)25 ℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液的pH范围为____________。
【答案】13 10 1.8×10-7 2 5.0<pH<7.1
【解析】
(1)酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-);
(2)根据图象判断该温度下水的离子积,然后计算出混合液中氢氧根离子浓度,再结合该温度下水的离子积计算出所带溶液中氢离子浓度及溶液的pH;
(3)首先计算n(AgNO3)和n(HCl),判断反应的过量情况,再计算剩余溶液中c(Cl-)或c(Ag+)=![]() ;溶液中氢离子不参加反应,先计算混合溶液中c(H+),再计算pH;
;溶液中氢离子不参加反应,先计算混合溶液中c(H+),再计算pH;
(4)pH=7.1时Mn(OH)2开始沉淀,室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析判断。
(1)氯化氢和氢氧化钡都是强电解质,酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-b mol/L×0.1L,则a+b=13,故答案为a+b=13;
(2)在曲线B中,水的离子积为:10-6×10-6=10-12,0.02mol/L的Ba(OH)2溶液中c(OH-)=0.04mol/L,NaHSO4溶液的浓度为0.02mol/L,c(H+)=0.02mol/L,当二者等体积混合后,溶液中的c(OH-)=![]() =0.01mol/L,则c(H+)=
=0.01mol/L,则c(H+)=![]() mol/L =10-10mol/L,该溶液的pH=10,故答案为10;
mol/L =10-10mol/L,该溶液的pH=10,故答案为10;
(3)n(AgNO3)=0.018mol/L×0.05L=0.0009mol,n(HCl)=0.020mol/L×0.05L=0.001mol>n(AgNO3),所以HCl有剩余,剩余溶液中c(Cl-)=![]() mol/L=10-3mol/L,c(Ag+)=
mol/L=10-3mol/L,c(Ag+)=![]() =
=![]() mol/L=1.8×10-7mol/L;溶液中氢离子不参加反应,则混合溶液中c(H+)=
mol/L=1.8×10-7mol/L;溶液中氢离子不参加反应,则混合溶液中c(H+)=![]() =0.01mol/L,则溶液的pH=2,故答案为1.8×10-7;2;
=0.01mol/L,则溶液的pH=2,故答案为1.8×10-7;2;
(4)pH=7.1时Mn(OH)2开始沉淀,室温下,除去MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6molL-1,解得:c(OH-)=1×10-9molL-1,c(H+)=1×10-5molL-1,此时pH=5,同理Fe(OH)3完全变成沉淀时,pH约为3.5,因此除去MnSO4溶液中的Fe3+、Al3+的pH范围是:5.0<pH<7.1,故答案为5.0<pH<7.1。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】用如图实验装置进行实验不能达到目的是( )
选项 | 反应及实验目的 | 试剂X | 试剂Y |
|
A | 电石与饱和食盐水混合,检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 | |
B | 二氧化锰与浓盐酸混合加热,验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 | |
C | 乙醇与浓硫酸加热至170℃,证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 | |
D | 乙酸溶液与碳酸钠固体混合,探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
A.AB.BC.CD.D