题目内容
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
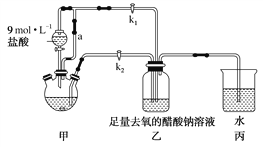
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
【答案】 保证分液漏斗中的液体顺利流下 2Cr3++Zn===2Cr2++Zn2+ 关闭k1,打开k2 防止空气进入装置乙氧化二价铬 bca 73.4% 混合气体通入澄清石灰水,变浑浊,说明混合气体中含有CO2;混合气体通过灼热的氧化铜,固体颜色由黑色变红色,说明混合体中含有CO
【解析】试题分析:(1)反应中有气体生成,会导致装置内压强增大,则装置甲中连通管a的作用是平衡压强,使分液漏斗中的液体顺利滴下。
(2) Cr3+具有氧化性,能氧化金属锌,则三颈瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为Zn+2Cr3+=2Cr2++Zn2+。
(3)要实现步骤③中溶液自动转移至装置乙中,则可以借助于压强的变化来实现,由于三颈烧瓶中产生气体,所以实验操作为关闭K1,打开K2。
(4)由于空气中含有氧气,氧气能氧化二价铬,则装置丙中导管口水封的目的是防止空气进入装置乙氧化二价铬。
(5)由于醋酸亚铬水合物是一种氧气吸收剂,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂),所以洗涤产品时,为了去除可溶性杂质和水分,正确使用顺序是先用去氧冷的蒸馏水,然后用乙醇,最后用乙醚,答案为bca。
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则根据原子守恒可知理论上得到产品的质量是![]() ,所以产率是
,所以产率是![]() 。
。
(7)二氧化碳能使澄清的石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳;CO具有还原性,可以用氧化铜检验,即混合气体通入澄清石灰水,变浑浊,说明混合气体中含有CO2;混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
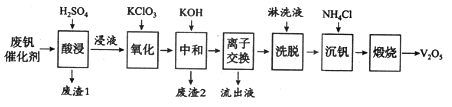
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。