题目内容
【题目】某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+===I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
实验序号 | 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1 Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1=________ mL,V2=________ mL。
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。实验步骤:
ⅰ.向5 mL 0.1 mol·L-1 KI溶液中滴加5~6滴0.1 mol·L-1 FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①将KI和FeCl3反应的离子方程式补充完整:____I-+____Fe3+ ![]() ____I2+____Fe2+。
____I2+____Fe2+。
②步骤ⅲ中,试剂X是_________________。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,该实验现象是________________________________。
【答案】40 10 2 2 1 2 KSCN溶液 ⅱ中可观察到溶液分层,下层呈现紫红色,ⅲ中可观察到溶液变红
【解析】
(1)①和②温度不同,应该时探究温度对速率的影响,因此浓度要求相同,即溶液的总体积相同,则V1+5+5=5+5+40,得V1=40;②和③温度相同,应该时探究浓度对速率的影响,图表中KIO3酸性溶液体积相同,可知是改变亚硫酸钠的浓度,为达到溶液体积相同,5+V2+35=5+5+40,得V2=10;
(2)①结合电子守恒,每生成1个I2转移2e-时,也生成2个Fe2+,再利用电荷守恒及原子守恒可得配平后的离子反应方程式:2I-+2Fe3+=I2+2Fe2+;
②利用KSCN溶液检验反应后的溶液里存在Fe3+;
③当ⅱ中可观察到溶液分层,下层呈现紫红色时可知反应后的溶液里有I2,ⅲ中滴加KSCN溶液后可观察到溶液变红,可知溶液里存在Fe3+,由此可推出反应存在一定限度。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
时间t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是____。
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=___;前2小时C的反应速率是____;计算平衡时A的转化率_____。
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为____。(保留两位有效数字)
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式______。
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式____。
【题目】FeCl2是一种常用的还原剂,有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl,C6H4Cl2,苯,易吸水 | ||
熔点/℃ | -45 | 53 | — | — |
沸点/℃ | 132 | 173 | — | — |
实验室可以用多种方法来制备无水FeCl2。回答下列问题:
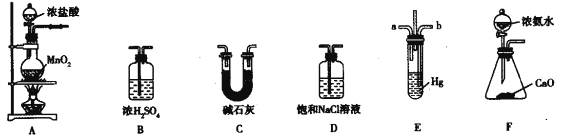
Ⅰ.按下如图装置用H2还原无水FeCl3制取。
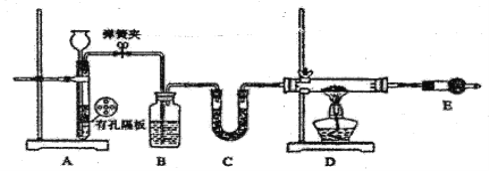
(1)用装置A制取H2,其优点是________________;D中反应的化学方程式为____________________;装置E的作用是____________________________。
(2)通入足量H2,充分反应,如果温度控制不当,产品中会含单质铁,检验产品中是否含铁的方案是____________________________。
Ⅱ.按图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
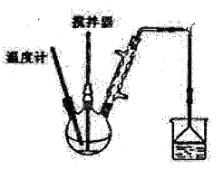
(3)上述反应中,还原剂是____________。
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是____________________________。
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品。
①洗涤所用的试剂可以是____________________________;
②简述回收滤液中C6H5Cl的方案____________________________。