题目内容
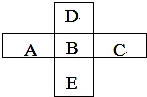 A、B、C、D、E五种主族元素所处周期表的位置如图所示.
A、B、C、D、E五种主族元素所处周期表的位置如图所示.知A元素能与氧元素形成化合物AO2,AO2中氧的质量分数为50%,且A原子中质子数等于中子数,则A元素的原子序数为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A元素能与氧元素形成化合物AO2,AO2中氧的质量分数为50%,则A元素的相对分子质量为32,且A原子中质子数等于中子数,则其质子数为16,故A为S元素,可推知B为Cl、C为Ar、D为F、E为Br,据此解答.
解答:
解:A元素能与氧元素形成化合物AO2,AO2中氧的质量分数为50%,则A元素的相对分子质量为32,且A原子中质子数等于中子数,则其质子数为16,故A为S元素,可推知B为Cl、C为Ar、D为F、E为Br,则:
A为S元素,其原子序数为16,其氧化物除了SO2外还有SO3;D为F元素,E的单质为Br2,与Ar原子具有相同核外电子排布的负一价阴离子为Cl-,离子结构示意图为: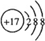 ,
,
故答案为:16;SO3;F;Br2; .
.
A为S元素,其原子序数为16,其氧化物除了SO2外还有SO3;D为F元素,E的单质为Br2,与Ar原子具有相同核外电子排布的负一价阴离子为Cl-,离子结构示意图为:
 ,
,故答案为:16;SO3;F;Br2;
 .
.
点评:本题考查元素推断与元素周期表,比较基础,确定A为S元素是关键,侧重对基础知识的巩固.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
丙烷和氯气发生取代反应生成二氯丙烷的同分异构体的数目有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
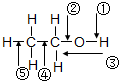 乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明不正确的是( )
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明不正确的是( )| A、和金属钠反应时,键①断裂 |
| B、和浓硫酸共热至170℃时,键②和⑤断裂 |
| C、乙醇完全燃烧时,断裂键①② |
| D、在铜催化下和氧气反应时,键①和③断裂 |