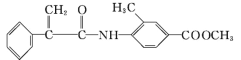
题目内容
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
![]() 时溶解度
时溶解度![]() 克
克![]() 克水
克水![]() ,
,![]() :111,
:111,![]() :
:![]()

![]() 稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
A ![]() 酒精
酒精 ![]() 双氧水
双氧水 ![]() 苯酚
苯酚 ![]() “84”消毒液
“84”消毒液![]() 溶液
溶液![]()
![]() 操作Ⅰ的名称是____;操作Ⅱ是根据
操作Ⅰ的名称是____;操作Ⅱ是根据![]() 和
和![]() 两物质在____
两物质在____![]() 填性质
填性质![]() 上差异,采用____
上差异,采用____![]() 填操作步骤
填操作步骤![]() 、趁热过滤得到
、趁热过滤得到![]() 粗晶体的。
粗晶体的。
![]() 上述流程中可以循环使用的物质有石灰、
上述流程中可以循环使用的物质有石灰、![]() 、____和____
、____和____![]() 写化学式
写化学式![]() 。
。
![]() 向
向![]() 溶液中通入
溶液中通入![]() 以制备
以制备![]() ,该反应中的还原剂是_________。
,该反应中的还原剂是_________。
![]() 铋酸钠
铋酸钠![]() ,不溶于水
,不溶于水![]() 用于定性检验酸性溶液中
用于定性检验酸性溶液中![]() 的存在
的存在![]() 铋元素的还原产物为
铋元素的还原产物为![]() ,Mn的氧化产物为
,Mn的氧化产物为![]() 价
价![]() ,写出反应的离子方程式_________。
,写出反应的离子方程式_________。
![]() 写出
写出![]() 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
![]() 若不考虑物质循环与制备过程中的损失,则
若不考虑物质循环与制备过程中的损失,则![]() 可制得____
可制得____![]() 。
。
【答案】![]() 过滤 溶解性 蒸发结晶
过滤 溶解性 蒸发结晶 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 或
或![]()
【解析】
二氧化锰与氢氧化钾在空气中熔融,加水溶解得到![]() 溶液,通入二氧化碳得到
溶液,通入二氧化碳得到![]() 、
、![]() 、
、![]() ,过滤除去滤渣
,过滤除去滤渣![]() ,滤液为
,滤液为![]() 、
、![]() 溶液,浓缩结晶,趁热过滤得到
溶液,浓缩结晶,趁热过滤得到![]() 晶体,母液中含有
晶体,母液中含有![]() ,在母液中加石灰
,在母液中加石灰![]() 氢氧化钙
氢氧化钙![]() 得到碳酸钙沉淀和KOH。
得到碳酸钙沉淀和KOH。
![]() 有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样。
有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样。![]() 操作Ⅰ是分离固体与溶液,是过滤操作,
操作Ⅰ是分离固体与溶液,是过滤操作,![]() 和
和![]() 在溶解性上不同,蒸发结晶、趁热过滤可得到
在溶解性上不同,蒸发结晶、趁热过滤可得到![]() 粗晶体。
粗晶体。
![]() 制备中利用的原料,在转化过程中又生成的可以循环利用。由转化关系图知,除石灰、二氧化碳外,
制备中利用的原料,在转化过程中又生成的可以循环利用。由转化关系图知,除石灰、二氧化碳外,![]() 溶液中通入
溶液中通入![]() 以制备
以制备![]() 生成的
生成的![]() 及最后由母液加入石灰生成的KOH,会在
及最后由母液加入石灰生成的KOH,会在![]() 、KOH的熔融制备
、KOH的熔融制备![]() 中被循环利用。
中被循环利用。
![]() 由工艺流程转化关系可知,向
由工艺流程转化关系可知,向![]() 溶液中通入
溶液中通入![]() 制备
制备![]() 、还生成
、还生成![]() 、
、![]() ,反应只有Mn元素的化合价发生变化,由
,反应只有Mn元素的化合价发生变化,由![]() 价降低为
价降低为![]() 价,由
价,由![]() 价升高为
价升高为![]() 价,所以
价,所以![]() 既是氧化剂又是还原剂。
既是氧化剂又是还原剂。
![]() 铋酸钠
铋酸钠![]() 不溶于水
不溶于水![]() 在酸性溶液中与
在酸性溶液中与![]() 反应生成
反应生成![]() 和
和![]() 。
。
![]() 由工艺流程转化关系可知,
由工艺流程转化关系可知,![]() 、KOH的熔融混合物中通入空气时发生反应生成
、KOH的熔融混合物中通入空气时发生反应生成![]() ,根据元素守恒还应生成水。反应中锰元素由
,根据元素守恒还应生成水。反应中锰元素由![]() 价升高为
价升高为![]() 价,总共升高2价,氧元素由0价降低为
价,总共升高2价,氧元素由0价降低为![]() 价,总共降低4价,化合价升降最小公倍数为4,所以
价,总共降低4价,化合价升降最小公倍数为4,所以![]() 系数2,
系数2,![]() 系数为1,根据锰元素守恒确定
系数为1,根据锰元素守恒确定![]() 系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定
系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定![]() 系数为2。
系数为2。
![]() 由
由![]()
![]()
![]() 可知最初的原料中
可知最初的原料中![]() 恰好得到
恰好得到![]() ,由
,由![]() 知,
知,![]() 在反应中能得到
在反应中能得到![]() 。
。
![]() 有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样。
有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样。
故答案为:BD;
![]() 操作Ⅰ是分离固体与溶液,是过滤操作,
操作Ⅰ是分离固体与溶液,是过滤操作,![]() 和
和![]() 在溶解性上不同,蒸发结晶、趁热过滤可得到
在溶解性上不同,蒸发结晶、趁热过滤可得到![]() 粗晶体。故答案为:过滤;溶解性;蒸发结晶;
粗晶体。故答案为:过滤;溶解性;蒸发结晶;
![]() 制备中利用的原料,在转化过程中又生成的可以循环利用。由转化关系图知,除石灰、二氧化碳外,
制备中利用的原料,在转化过程中又生成的可以循环利用。由转化关系图知,除石灰、二氧化碳外,![]() 溶液中通入
溶液中通入![]() 以制备
以制备![]() 生成的
生成的![]() 及最后由母液加入石灰生成的KOH,会在
及最后由母液加入石灰生成的KOH,会在![]() 、KOH的熔融制备
、KOH的熔融制备![]() 中被循环利用。故答案为:KOH、
中被循环利用。故答案为:KOH、![]() ;
;
![]() 由工艺流程转化关系可知,向
由工艺流程转化关系可知,向![]() 溶液中通入
溶液中通入![]() 制备
制备![]() 、还生成
、还生成![]() 、
、![]() ,反应只有Mn元素的化合价发生变化,由
,反应只有Mn元素的化合价发生变化,由![]() 价降低为
价降低为![]() 价,由
价,由![]() 价升高为
价升高为![]() 价,所以
价,所以![]() 既是氧化剂又是还原剂。故答案为:
既是氧化剂又是还原剂。故答案为:![]() ;
;
![]() 铋酸钠
铋酸钠![]() 不溶于水
不溶于水![]() 在酸性溶液中与
在酸性溶液中与![]() 反应生成
反应生成![]() 和
和![]() ,则反应的离子方程式为:
,则反应的离子方程式为:![]() 。
。
故答案为:![]() ;
;
![]() 由工艺流程转化关系可知,
由工艺流程转化关系可知,![]() 、KOH的熔融混合物中通入空气时发生反应生成
、KOH的熔融混合物中通入空气时发生反应生成![]() ,根据元素守恒还应生成水。反应中锰元素由
,根据元素守恒还应生成水。反应中锰元素由![]() 价升高为
价升高为![]() 价,总共升高2价,氧元素由0价降低为
价,总共升高2价,氧元素由0价降低为![]() 价,总共降低4价,化合价升降最小公倍数为4,所以
价,总共降低4价,化合价升降最小公倍数为4,所以![]() 系数2,
系数2,![]() 系数为1,根据锰元素守恒确定
系数为1,根据锰元素守恒确定![]() 系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定
系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定![]() 系数为2,所以反应方程式为
系数为2,所以反应方程式为![]()
![]()
![]() 。故答案为:
。故答案为:![]()
![]()
![]() ;
;
![]() 由
由![]()
![]()
![]() 可知最初的原料中
可知最初的原料中![]() 恰好得到
恰好得到![]() ,由
,由![]() 知,
知,![]() 在反应中能得到
在反应中能得到![]() 。故答案为:
。故答案为:![]() 或
或![]() 。
。

【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
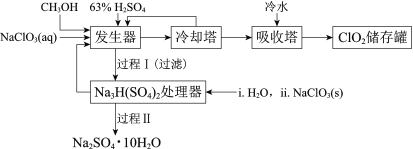
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
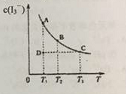
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:

①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
【题目】实验室用50mL0.50mol·L-1盐酸、50mL0.50mol·L-1NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度 | 终止温度 | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
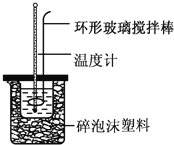
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)根据上表中所测数据进行计算,则该实验测得的中和热△H=__________(盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容C按4.18J(g℃)-1计算,结果保留小数点后一位)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,则实验中测得的“中和热”为△H1,则△H1与△H的关系为△H1________△H(填“大于”、“小于”、“等于”)。如改用60mL0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是___(填字母序号)。
A 测量盐酸的温度后,温度计没有用水冲洗干净
B 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C 做本实验的当天室温较高
D 将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E 在量取盐酸时仰视计数
F 大烧杯的盖板中间小孔太大.