题目内容
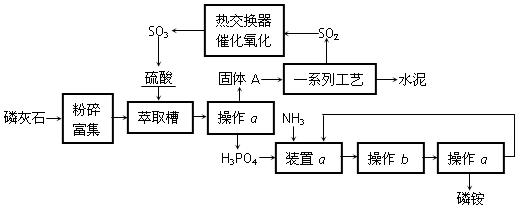
合成氨工业中选择20MP~50MP的压强,而没有选择更高的压强,理由是 ;硫酸工业中选择475℃的温度,而不是选择常温,理由是 。在吸收塔中三氧化硫的吸收剂是 ,选择该吸收剂的优点是
压强增大,动力及设备要求增大,成本提高;
该温度是催化剂的活性温度。
98.3%硫酸,不会形成酸雾,易于SO3的吸收
该温度是催化剂的活性温度。
98.3%硫酸,不会形成酸雾,易于SO3的吸收
略

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
 软锰矿制备高锰酸钾的一种工艺流程。
软锰矿制备高锰酸钾的一种工艺流程。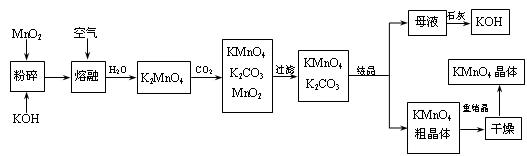

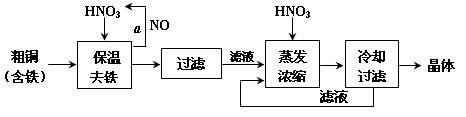
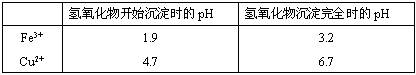
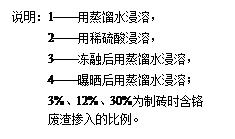
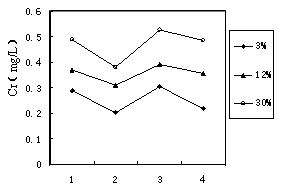
 Cr(OH)3
Cr(OH)3 CrO2-① FeSO4还原Cr2O72-的离子方程式为 。
CrO2-① FeSO4还原Cr2O72-的离子方程式为 。