题目内容
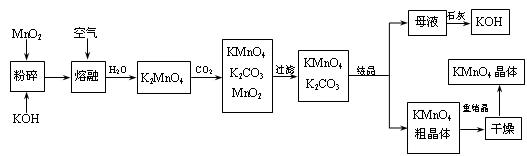
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用 软锰矿制备高锰酸钾的一种工艺流程。
软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列 (填序号)物质相似。
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是: 。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 (写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
 软锰矿制备高锰酸钾的一种工艺流程。
软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列 (填序号)物质相似。
| A.75%酒精 | B.双氧水 | C.苯酚 | D.84消毒液(NaClO溶液) |
。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是: 。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 (写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(1)BD
(2)2MnO2 + 4KOH + O2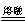 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O
(3)K2MnO4
(4)KOH、MnO2
(5)0.67或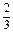
(2)2MnO2 + 4KOH + O2
 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O(3)K2MnO4
(4)KOH、MnO2
(5)0.67或
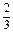
略

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
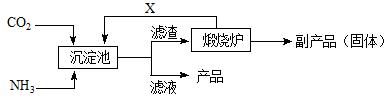

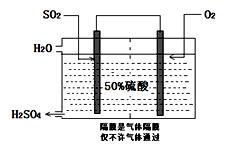
 氨碱法”中CO2来源于 ;
氨碱法”中CO2来源于 ;
 CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3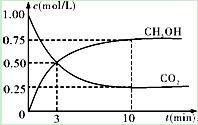
 O
O  Na2CO3
Na2CO3 +CO2↑+H2O
+CO2↑+H2O  所以在溶液中首先结晶析出
所以在溶液中首先结晶析出 碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。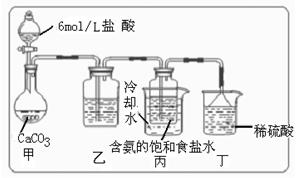
 (Ⅰ)乙装置中的试剂是
(Ⅰ)乙装置中的试剂是 
 压强(Mpa)
压强(Mpa) 氨的平
氨的平 5.4
5.4