题目内容
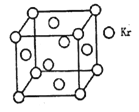
【题目】A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:

试填写下列空白:
(1)甲元素的单质在空气中燃烧产物除了得到A外,还可得到_____________,物质F的电子式为____________。
(2)反应“E+D→G+B”是制硝酸工业中的重要反应之一,其方程式为______________“E+CuO”的化学方程式为_________________
(3)C和D还能在一定条件下反应生成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为_________________
【答案】(1)MgO和 C ![]()
(2)4NH3+5O2![]() 4NO+6H2O;2NH3+3CuO
4NO+6H2O;2NH3+3CuO![]() 3Cu+N2+3H2O(3)H2O2+SO2=2H++SO42-
3Cu+N2+3H2O(3)H2O2+SO2=2H++SO42-
【解析】
试题分析:A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,因此甲是第ⅡA元素;C为单质,其原子在周期表中半径最小,C是H。D为气体,对空气的相对密度为1.103,所以D的相对分子质量是1.103×29=32,因此D是氧气;E的水溶液显碱性,能与氧气反应生成G和B,G可以继续与氧气反应生成H,所以E是氨气,G是NO,H是NO2,B是H2O。K为乙元素的单质。A和水反应生成氨气和F,所以A是氮化镁,F是氢氧化镁。氨气在加热条件下还原氧化铜生成铜、氮气和水,则乙元素是N甲元素是Mg。
(1)金属镁能与氧气、氮气和CO2反应,所以镁元素的单质在空气中燃烧产物除了得到A外,还可得到MgO和 C,氢氧化镁的电子式为![]() 。
。
(2)反应“E + D→G + B”是制硝酸工业中的重要反应之一,其方程式为4NH3+5O2![]() 4NO+6H2O, “E + CuO”的化学方程式为 2NH3+3CuO
4NO+6H2O, “E + CuO”的化学方程式为 2NH3+3CuO![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(3)C和D还能在一定条件下反应生成另一种化合物I,I是双氧水,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为H2O2+SO2=2H++SO42-。