题目内容
【题目】我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) Zn2+在基态时核外电子排布式为 。
(2) SO42-的空间构型是 (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下HCOOH沸点比CH3OCH3高,说明前者是极性分子后者是非极性分子
②1mo1PAN中含σ键数目为 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为 (填数字).
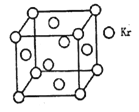
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= (填数字)。
【答案】(1)1s22s22p63s23p63d10或[Ar]3d10(2)正四面体
(3)①ac②10mol(或10×6.02×1023或6.02×1022)③6(4)3
【解析】
试题分析:(1)Zn为30号元素,所以Zn2+在基态时核外电子排布式为:1s22s22p63s23p63d10或[Ar]3d10;
(2)SO42-中心原子含有4个σ键,孤电子对数=1/2×(6+2-4×2)=0,S原子的杂化方式为sp3,所以其空间构型为正四面体结构。
(3)①a、N2O与CO2互为等电子体,二者形成的化学键相似,故N2O结构式可表示为N=N=O,a正确;b、O3与SO2互为等电子体,为V形分子,b错误;c、CH2=CH-CHO中每个碳原子均形成两个单键和一个双键,故均为sp2杂化,c正确;d、HCOOH分子间可以形成氢键,CH3OCH3分子间只有范德华力,氢键的作用强于范德华力,所以HCOOH沸点比CH3OCH3高,与分子的极性无关,d错误。答案选ac;
②PAN中所有单键均为σ键,双键中有一个为σ键,-NO2的结构为![]() ,所以PAN(CH3COOONO2)分子中含有10个σ键,则1mo1PAN含σ键数目为10mol(或10×6.02×1023或6.02×1022)。
,所以PAN(CH3COOONO2)分子中含有10个σ键,则1mo1PAN含σ键数目为10mol(或10×6.02×1023或6.02×1022)。
③配体位于方括号中,由1个NO和5个H2O构成,则配位数为6。
(4)根据均摊法,以顶点计算,与之相邻最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故最近的Kr为3×8/2=12,晶胞中Kr有8×1/8+6×1/2=4,两者比值为12:4=3。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
