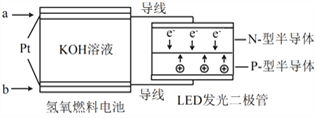
题目内容
【题目】在一定条件下,反应A2(g)+B2(g)![]() 2AB(g) 达到平衡状态的标志是( )
2AB(g) 达到平衡状态的标志是( )
A. 单位时间内生成n mol A2的同时,生成n mol的AB
B. 单位时间内生成2n mol AB的同时,生成n mol的B2
C. 单位时间内,生成n mol A2的同时,生成n mol的B2
D. 容器内的总压强不随时间而变化
【答案】B
【解析】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A、单位时间内生成nmolA2需要消耗2molAB,单位时间内生成nmol A2的同时生成nmol的AB,单位时间内AB的生成与消耗的物质的量不相等,反应未达平衡状态,选项A错误;B、单位时间内生成2nmolAB的同时,生成n mol的B2,生成2nmolAB需要消耗nmol的B2,单位时间内B2的生成与消耗的物质的量相等,反应到达平衡状态,选项B正确;C、单位时间内,生成nmolA2的同时,生成nmol的B2,都表示逆反应速率,不能说明反应到达平衡状态,选项C错误;D、反应前后气体的物质的量不变,混合气体的压强始终不变,容器内的总压强不随时间而变化,不能说明到达平衡状态,选项D错误;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D