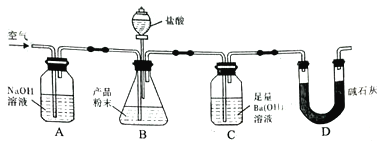
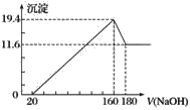
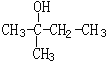题目内容
【题目】一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:

(1)t1时刻N的转化率为____________。
(2)0~t3时间内用M表示的化学反应速率为____________mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________。
(4)该反应的化学方程式为______;t2时刻,正逆反应速率大小:v正 ____v逆(填“>”、“=”或“<”)。
(5)下列能表示上述反应达到化学平衡状态的是____________(填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
【答案】25% ![]() 7:10 2N(g)
7:10 2N(g)![]() M(g) > BD 946
M(g) > BD 946
【解析】
根据图像分析,从反应开始到平衡M、N的物质的量变化量分别为3mol、6mol,得出反应方程式为2N(g)![]() M(g)。
M(g)。
(1)t1时刻N的物质的量为6mol,N起始的物质的量为8mol,其转化率为![]() 。
。
(2)0~t3时间内用M表示的化学反应速率![]() 。
。
(3)恒温恒容的密闭容器中,压强之比等于气体分子的物质的量之比,则平衡时容器内气体的压强与起始时容器内压强的比值为7:10。
(4)综上分析,该反应的化学方程式为2N(g)![]() M(g);t2时刻,反应未达到平衡,此时反应继续向正向移动,正逆反应速率大小:v正>v逆。
M(g);t2时刻,反应未达到平衡,此时反应继续向正向移动,正逆反应速率大小:v正>v逆。
(5) A.当正逆反应速率相等时,反应达到平衡,根据化学计量数,2v逆(M)=v正(N)时反应达到平衡,A错误;
B.起始时M与N的物质的量之比为1:4,平衡时M与N的物质的量之比为5:2,M与N的物质的量之比由变到不变并保持不变,则反应达到平衡,B正确;
C.混合气体的质量不变,容器的体积不变,则混合气体密度一直保持不变,不能说明反应达到平衡状态,C错误;
D.该反应为反应前后气体分子数改变的反应,则容器中压强由变到保持不变,说明反应达到平衡状态,D正确;
答案选BD。
(6)合成氨反应为N2+3H2![]() 2NH3,反应放出能量=成键释放的能量-断键吸收的能量,设N≡N的键能为x kJ/mol,则2×46kJ=(391kJ/mol×6)-(x+436kJ/mol×3),求得x=946 kJ/mol,则N≡N的键能为946 kJ/mol。
2NH3,反应放出能量=成键释放的能量-断键吸收的能量,设N≡N的键能为x kJ/mol,则2×46kJ=(391kJ/mol×6)-(x+436kJ/mol×3),求得x=946 kJ/mol,则N≡N的键能为946 kJ/mol。