题目内容
【题目】按要求回答下列问题:
(1)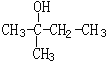 的系统命名:______________________它的H-NMR谱中有________个峰,峰的面积比为___________________
的系统命名:______________________它的H-NMR谱中有________个峰,峰的面积比为___________________
(2)写出 2,3-二甲基-4-乙基已烷结构简式_________________CH3CH2CH2CHO 的键线式___________________________________________________________
(3)写出CH3CH2OH催化氧化的化学方程式:__________________CH3CH2Br制取乙醇的化学方程式:______________________
【答案】2-甲基-2-丁醇 4 6:3:2:1 CH3CH(CH3)CH(CH3)CH(CH2CH3)2 ![]() 2CH3CH2OH+O2→2CH3CHO+2H2O CH3CH2Br+NaOH→CH3CH2OH+NaBr
2CH3CH2OH+O2→2CH3CHO+2H2O CH3CH2Br+NaOH→CH3CH2OH+NaBr
【解析】
(1) 的主链为丁醇,羟基在2号碳原子,名称为:2-甲基-2-丁醇;分子中有4种氢原子,所以它的H-NMR谱中有4个峰;峰的面积比等于氢原子数之比=6:3:2:1,故答案为:2-甲基-2-丁醇;4;6:3:2:1。
的主链为丁醇,羟基在2号碳原子,名称为:2-甲基-2-丁醇;分子中有4种氢原子,所以它的H-NMR谱中有4个峰;峰的面积比等于氢原子数之比=6:3:2:1,故答案为:2-甲基-2-丁醇;4;6:3:2:1。
(2)2,3-二甲基-4-乙基已烷,最长的主链含有6个碳原子,甲基位于2、3号碳原子,乙基位于4号碳原子,其结构简式为:CH3CH(CH3)CH(CH3)CH(CH2CH3)CH2CH3;CH3CH2CH2CHO中存在C=O,其键线式为:![]() ;故答案为:CH3CH(CH3)CH(CH3)CH(CH2CH3)CH2CH3;
;故答案为:CH3CH(CH3)CH(CH3)CH(CH2CH3)CH2CH3;![]() 。
。
(3)CH3CH2OH在铜作催化剂条件下被氧化为乙醛,化学方程式为:2CH3CH2OH+O2→2CH3CHO+2H2O,CH3CH2Br与NaOH发生水解反应生成乙醇,化学方程式为:CH3CH2Br+NaOH→CH3CH2OH+NaBr,故答案为:2CH3CH2OH+O2→2CH3CHO+2H2O;CH3CH2Br+NaOH→CH3CH2OH+NaBr。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案